
【题目】在A、B两个恒容密闭容器中发生反应:2NO22NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示:
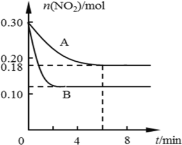
(1)若A容器的体积为5 L,反应经6 min达到平衡状态,则0~6 min内以O2浓度变化表示的反应速率为___________。
(2)该反应化学平衡常数K=__________(写出表达式)。
(3)说明该反应已达到平衡状态的是_______。
A.v正(NO2)=v逆(NO)B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(4)若A、B两容器中只是温度不同,则TA____TB (填“>”或“<”),请写出一条能提高二氧化氮转化率的措施_____________。
【答案】0.002 mol/(Lmin) 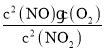 AC < 升高温度(或减小压强)
AC < 升高温度(或减小压强)
【解析】
(1)根据![]() 计算反应速率;
计算反应速率;
(2)平衡常数是可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比或反应产物与反应底物的浓度(方程式系数幂次方)乘积比。
(3)反应达到平衡状态,各组分的浓度不随着时间的变化而变化,正逆反应速率相等,根据化学平衡状态的特征结合变量不变的状态是平衡状态来回答;
(4)温度越高达到平衡所需时间越短,不增加NO2的物质的量使平衡右移即可增大其转化率。
(1)据图可知初始时n(NO2)=0.30mol,平衡时n(NO2)=0.18mol,△n(NO2)=0.12mol,△c(NO2)=![]() ,则
,则![]() ,同一反应中反应速率之比等于化学计量数之比,所以v(O2)=0.002 mol/(Lmin),故答案为:0.002 mol/(Lmin);
,同一反应中反应速率之比等于化学计量数之比,所以v(O2)=0.002 mol/(Lmin),故答案为:0.002 mol/(Lmin);
(2)根据平衡常数的定义可知该反应的平衡常数K=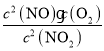 ,故答案为:
,故答案为: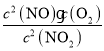 ;
;
(3)A.反应平衡时v正(NO2)=v逆(NO2),同一反应反应速率之比等于计量数之比,所以v逆(NO2)=v逆(NO),所以v正(NO2)=v逆(NO),可以说明反应已达平衡;
B.反应过程中c(NO2)减小,c(NO)增大,某一时刻二者可能相等,但不能说明反应平衡;
C.反应过程中气体总质量不变,但气体的物质的量在改变,即平均摩尔质量会变,所以当气体的平均摩尔质量不变时可以说明反应平衡;
D.气体总质量不变,体积不变,故密度一直不变,所以密度不变时不能说明反应平衡;
故答案为:AC;
(4)根据图可知容器B达到平衡所需时间更短,反应速率更大,温度更高,且平衡时二氧化氮浓度更低,说明温度升高平衡右移,正反应为吸热反应,升高温度可使平衡右移,增大二氧化氮的转化率,该反应为压强减小的反应,故减小压强可使平衡右移,增大二氧化氮的转化率,故答案为:<;升高温度(或减小压强)。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A.含有25.2g HNO3的浓硝酸与足量的铜反应产生的NO2分子数目为0.1NA
B.1L0.6mol/L的Na2CO3溶液中含有的O原子数目为1.8NA
C.标准状况下,22.4L的CH3COOH中含有的H原子个数为4NA
D.反应4NH3+6NO 5N2+6H2O中,当生成140g的N2时转移12NA
5N2+6H2O中,当生成140g的N2时转移12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.20mol·L-1的NaOH溶液滴定10.00mL 0.20mol·L-1的NaHSO3溶液,滴定过程中溶液的pH变化和滴加NaOH溶液的体积关系如图所示。下列说法错误的是( )

A.溶液中水的电离程度:b>a>c
B.pH=7时,消耗的V(NaOH)<10.00mL
C.在室温下K2(H2SO3)约为1.0×10-7
D.c点溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)![]() 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.放热反应B.吸热反应C.化合反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体![]() 又称摩尔盐,
又称摩尔盐,![]() ,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、
,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、![]() 、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
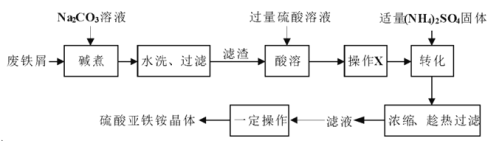
回答下列问题:
(1)“碱煮”的目的是___________。
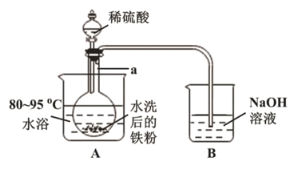
(2)“酸溶”在如图所示装置中完成(部分装置省略)。仪器![]() 的名称是______,反应过程中有臭鸡蛋气味气体产生,则装置
的名称是______,反应过程中有臭鸡蛋气味气体产生,则装置![]() 的作用是_____________________。
的作用是_____________________。
(3)欲检测“酸溶”所得溶液中是否含有![]() ,可选用试剂为_____________,结果表明溶液中不含
,可选用试剂为_____________,结果表明溶液中不含![]() ,原因是______________________。“操作
,原因是______________________。“操作![]() ”是加入铁粉,指出该操作的主要目的是________________。
”是加入铁粉,指出该操作的主要目的是________________。
(4)产品纯度测定:称取![]() 硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成
硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成![]() 溶液。量取
溶液。量取![]() 所配溶液于锥形瓶中,消耗
所配溶液于锥形瓶中,消耗![]() 酸性
酸性![]() 标准溶液体积为
标准溶液体积为![]() 。
。
①滴定过程反应的离子方程式为_____________。
②产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O ![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.①④B.③④C.②⑤D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率= _____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
III.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=____________。
(2)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向____________(填“正”、“逆”)反应方向移动。
(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
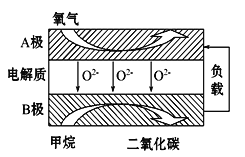
1)B极上的电极反应式为 。
2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的可逆反应CO(g)+2H2(g)![]() CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
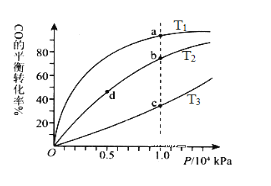
A.温度:T1< T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ;K(b) >K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com