
 ?CO2(g)+H2(g)
?CO2(g)+H2(g)| 1.2×1.2 |
| 0.8×1.8 |
| 1×1.5 |
| 2×1 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、该电池放电时将电能转变为化学能 |
| B、该电池放电时,电子通过外电路从正极流向负极 |
| C、该电池充电时将电池的碳纳米管与外接电源的正极相连 |
| D、该电池放电时,电池的负极反应为:LixC-xe-═xLi++C |
查看答案和解析>>
科目:高中化学 来源: 题型:
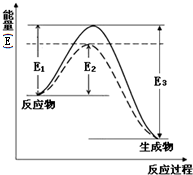 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 方法 |
| (1)提取草木灰中的K2CO3晶体; | |
| (2)提取沙砾中的碘 | |
| (3)碘水中提取碘; | |
| (4)氯化钠与氯化钾; | |
| (5)除去O2混有少量的CO2气体 | |
| (6)分离汽油和水; | |
| (7)除去生石灰中混有少量的碳酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
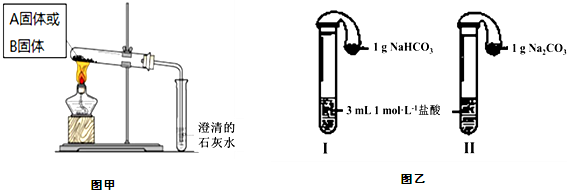
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2mL Na2CO3溶液中滴加1mL 0.5mol?L-1 CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应 | 有白色沉淀 |
| 实验2:向2mL NaHCO3溶液中滴加1mL 0.5mol?L-1 CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 | 有白色沉淀出现,同时有少量气泡冒出. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
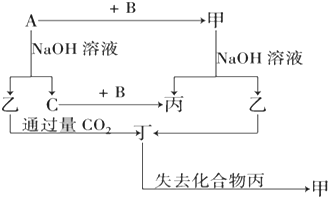 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com