
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | X单质可在氧气中燃烧生成XO3 | |
| C. | 离子半径大小:r (M3+)>r (T2-) | |
| D. | L2+和X2-的核外电子数相等 |
分析 短周期主族元素中,元素最高正化合价与其族序数增大,最低负化合价=族序数-8,原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,L、R属于第IIA族元素,原子半径L>R,则L是Mg、R是Be元素;
M属于第IIIA族元素,原子半径M>R,则M是Al元素;
X、T最低负价是-2,则X和T属于第VIA族元素,X有正化合价、T没有正化合价,所以X是S、T是O元素,
A.R是Be元素,氢氧化铍具有两性;
B.X是S元素,S单质在氧气中燃烧生成二氧化硫;
C.M是Al元素、T是O元素,电子层结构相同的离子,离子半径随着原子序数增大而减小;
D.L是Mg元素、X是S元素,镁离子核外有10个电子、硫离子核外有18个电子.
解答 解:短周期主族元素中,元素最高正化合价与其族序数增大,最低负化合价=族序数-8,原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,L、R属于第IIA族元素,原子半径L>R,则L是Mg、R是Be元素;
M属于第IIIA族元素,原子半径M>R,则M是Al元素;
X、T最低负价是-2,则X和T属于第VIA族元素,X有正化合价、T没有正化合价,所以X是S、T是O元素,
A.R是Be元素,根据对角线规则知,Al和Be性质相似,所以氢氧化铍可能具有两性,故A正确;
B.X是S元素,S单质在氧气中燃烧生成二氧化硫,二氧化硫和氧气在催化剂、加热条件下反应生成三氧化硫,故B错误;
C.M是Al元素、T是O元素,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径r(M3+)<r(T2-),故C错误;
D.L是Mg元素、X是S元素,镁离子核外有10个电子、硫离子核外有18个电子,所以两种离子核外电子数不等,故D错误;
故选A.
点评 本题考查原子结构和元素性质,侧重考查分析推断能力,明确主族元素化合价与族序数的关系、原子半径规律即可解答,注意元素周期表中元素性质遵循对角线规则,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系 | |
| B. | 铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系 | |
| C. | 将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系 | |
| D. | H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
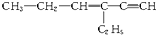 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )| A. | 4,3,5 | B. | 4,3,6 | C. | 2,5,4 | D. | 4,6,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 加热能杀死流感病毒式因为病毒的蛋白质受热变性 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com