
| A. | 将 CO2 通入次氯酸钙溶液可生成次氯酸 | |
| B. | 钠在氧气中燃烧主要生成Na2O | |
| C. | Na2O、Na2O2 组成元素相同,与 CO2 反应产物也相同 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
分析 A.碳酸的酸性强于次氯酸;
B.钠在氧气中燃烧生成过氧化钠;
C.Na2O与CO2发生化合生成Na2CO3,Na2O2与CO2发生化合生成Na2CO3和氧气;
D.新制氯水中存在化学平衡,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用;
解答 解:A.碳酸的酸性强于次氯酸,将少量CO2通入次氯酸钙溶液反应生成碳酸钙、次氯酸和水,故A正确;
B.钠在空气中反应生成氧化钠,钠在氧气中燃烧生成淡黄色固体过氧化钠Na2O2,故B错误;
C.Na2O、Na2O2 组成元素相同,与 CO2 反应产物不相同,Na2O与CO2发生化合生成Na2CO3,Na2O2与CO2发生化合生成Na2CO3和氧气,故C错误;
D.新制氯水中存在化学平衡,Cl2+H2O?HCl+HClO,氯气和水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白作用,向其中滴加少量紫色石蕊试液,充分振荡后溶液先呈红色后褪色,故D错误;
故选A.
点评 本题考查钠的重要化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握过氧化钠与水、二氧化碳反应的特点,学习中注意相关基础知识的积累,注意次氯酸的漂白作用分析,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
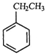 (g)+CO2(g)?
(g)+CO2(g)?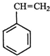 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ ,该聚合物的链节为
,该聚合物的链节为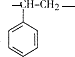 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| C. | 氨水与FeCl3溶液反应:3OH-+Fe3+═Fe(OH)3↓ | |
| D. | NaOH与盐酸反应:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失电子越多,还原性就一定越强 | |
| B. | 某元素由单质变为化合物,该元素有可能被氧化也有可能被还原 | |
| C. | 某物质焰色反应呈黄色,该物质一定含钠单质,可能含钾单质 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
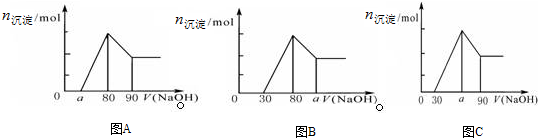
| A. | A图中a的取值范围为 0≤a<50 | |
| B. | A图中$\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
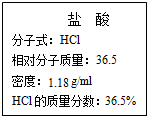 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ④⑥ | C. | ③④ | D. | ①④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com