
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液 |
② | 20mL 0.2mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液[来 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
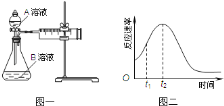
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是: .
【答案】(1)浓度;②;①;(各2分) (2)0.0056;
(3)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间;
(4)产物Mn2+(或MnSO4)是反应的催化剂
【解析】
试题分析:(1)对比①②实验可探究草酸的浓度对化学反应速率的影响;②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大。
(2)2.24mL CO2(标准状况下)的物质的量为1×10-4mol,根据反应2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,消耗MnO4-的物质的量为2×10-5mol,反应剩余的高锰酸根离子的物质的量为:
30×10-3L×0.01mol·L-1-0.00002mol=0.00028mol,
则在2min末,c(MnO4﹣)=0.00028mol÷0.05L=0.0056mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率。
(4)产物Mn2+(或MnSO4)是反应的催化剂,所以t1~t2时间内速率变快。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述不正确的是
A.C4H8O2的酯有4种结构
B.淀粉和纤维素互为同分异构体
C.乙醇和葡萄糖均能发生酯化反应
D.漂粉精和医用酒精均可用作消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石油的说法正确的是
A. 石油属于可再生矿物能源 B. 石油主要含有碳、氢两种元素
C. 石油裂化属于物理变化 D. 石油分馏属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N﹣N吸收167 kJ热量,生成1mol N≡N放出942 kJ。根据以上信息和数据,下列说法正确的是( )
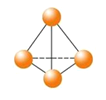
A.N4与N2互为同分异构体
B.1mo1N4气体转变为N2将吸收882 kJ热量
C.N4(g)═ 2N2(g) ΔH = - 882KJ
D.P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A.电解池是电能转化为化学能的装置
B.原电池跟电解池连接后,电子从原电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用惰性电极电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②除去乙炔中少量的H2S:气体通过盛有硫酸铜溶液的洗气瓶
③除去C2H6中少量的C2H4:气体通过盛有酸性高锰酸钾溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量新制生石灰,蒸馏
A. ②④ B. ①② C. ③④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较或归纳一定正确的是( )
A. 离子半径:阴离子>阳离子 B. 酸性:HClO4>H2SO4
C. 熔沸点:共价化合物>离子化合物 D. 稳定性:PH3>NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,可行的是
A.用萃取的方法可将汽油和煤油进行分离
B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉
C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物
D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com