
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
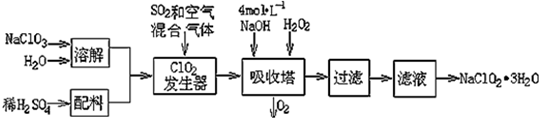
分析 (1)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,Cl元素化合价降低,被还原;则H2O2必定被氧化,有氧气产生,据此配平书写方程式;
反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移计算氧化剂与还原剂的物质的量之比,据此确定还原产物与氧化产物物质的量之比,计算还原反应生成的氯气,再根据m=nM计算;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(3)①、弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大;
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,故溶液碱性越强,氢离子浓度越小,含有阴阳离子总数的越小;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀;根据溶度积计算S2-的浓度.
解答 解:(1)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2,反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),故n(ClO2):n(HCl)=1:4,故还原产物与氧化产物物质的量之比为1:4,故还原反应生成的氯气为5mol×$\frac{1}{5}$=1mol,通过还原反应制得氯气的质量为1mol×71g/mol=71g,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;71;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,所以操作顺序为dc,故答案为:dc;
(3)①根据电离平衡常数可知酸性强弱顺序为:HClO2>HF>HCN>HS-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2),
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,溶液为碱性,pH(NaCN)>pH(NaF),故NaCN溶液碱氢离子浓度较小,含有阴阳离子总数较小,即NaF溶液中阴阳离子总数较大,
故答案为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);前者大;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS,Fe2+最后沉淀,沉淀完全时该浓度为10-5mol•L-1,此时的S2-的浓度为$\frac{6.3×10{\;}^{-18}}{10{\;}^{-5}}$mol/L=6.3×10-13mol/L,
故答案为:CuS;6.3×10-13mol/L.
点评 本题以学生比较陌生的亚氯酸钠制备为载体,考查学生阅读题目获取信息的能力、氧化还原反应计算、物质分离提纯、盐类水解、溶度积的有关计算与应用等,是在新情境下综合运用知识解决问题的能力的考查,题目有一定的难度.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
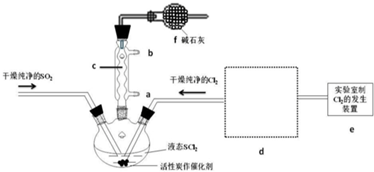
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 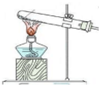 |  | 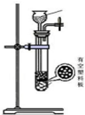 | 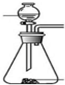 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com