
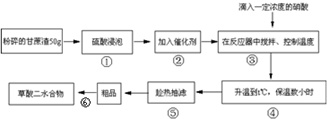
| 硫酸质量分数% | 草酸收率% | 甘蔗渣浸泡后现象 |
| 60 | 36.0 | 甘蔗呈糖浆状,大量为固体 |
| 65 | 60.3 | 大量呈糖浆状,少量为固体 |
| 70 | 72.1 | 呈糖浆状,色棕红 |
| 75 | 70.0 | 呈糖浆状,色棕黑 |
| 80 | 58.0 | 呈糖浆状,有部分炭化色发黑 |
| 浸泡时间/小时 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 草酸收率% | 52.1 | 61.6 | 72.1 | 71.5 | 71.9 | 72.0 | 71.7 |
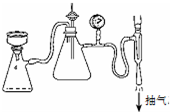 步骤⑥采用的操作方法是:
步骤⑥采用的操作方法是:| 5 |
| 2 |
| 5 |
| 2 |
| 250mL |
| 40mL |
| 126g/mol×0.025mol |
| 10.5g |


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
| A、次氟酸分子中原子间以共价键相结合 |
| B、次氟酸分解会产生F2 |
| C、次氟酸与热水反应可能有H2O2生成 |
| D、次氟酸的酸性可能比次氯酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 除杂质试剂(适量) | 化学方程式 | |
| HCl(H2SO4)溶液 | ||
| KCl(K2CO3)溶液 | ||
| Cu(Zn)固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
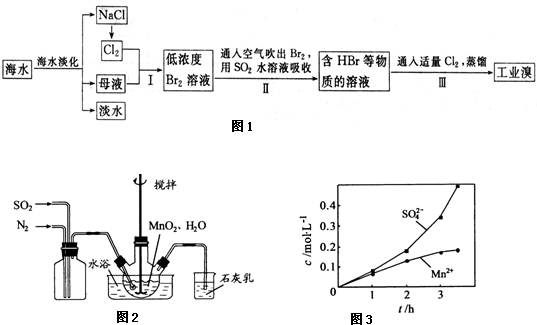
查看答案和解析>>
科目:高中化学 来源: 题型:
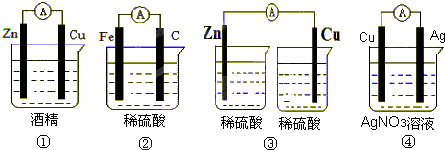
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com