
镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:
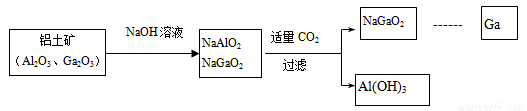
下列判断不合理的是:
A. Al、Ga均处于IIIA族
B. Ga2O3可与盐酸反应生成GaCl3
C. Ga(OH)3可与NaOH反应生成NaGaO2
D. 碱性:Al(OH)3>Ga(OH)3
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:计算题
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的物质的量为________mol,NO2的物质的量为________mol。
(2)待产生的气体全部释放后,向溶液中加入VmL、amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水_______g。
(书写计算过程)
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考三化学试卷(解析版) 题型:实验题
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易水解,易被氧化。某研究小组设计SnSO4制备路线如下:
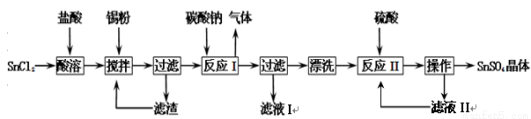
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是 ;
(2)反应I得到的沉淀是SnO,得到该沉淀的离子方程式是 ;
(3)在反应I得到沉淀SnO后,要进行“过滤”、“漂洗”,检验SnO是否洗涤干净的操作是 ;
(4)反应II之后的“操作”依次为 、 、过滤、洗涤、低温干燥;
(5)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3溶液;③用0.2000 mol/L 酸性K2Cr2O7溶液滴定(产物中Cr呈+3价)至终点,消耗K2Cr2O7溶液15.00 mL。写出酸性K2Cr2O7溶液滴定的离子方程式 ,则此锡粉样品中锡的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上联考四化学试卷(解析版) 题型:选择题
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的焰色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z的核电荷数是W的2倍,Y是地壳中含量最多的金属元素。下列说法不正确的是
A. 工业上常用电解的方法制备X、Y的单质
B. 元素Q和Z能形成QZ2型的共价化合物
C. 原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Q)
D. 元素X、Y、Z的最高价氧化物对应的水化物之间能相互发生反应
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三模拟四化学卷(解析版) 题型:实验题
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是 。完成酸浸过程中反应的离子方程式:
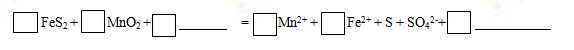
(2) 加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理: 。(结合离子方程式解释)
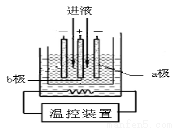
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是
极(填“a”或“b”),生成EMD的电极反应式是 。
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是 (填字母序号)。[来源
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:填空题
2016年10月17日我国神舟十一号载人飞船在酒泉卫星发射中心成功发射,为我们更好地掌握空间交会对接技术、开展地球观测活动奠定了基础。我国制造航天飞船的主要材料是铝,因而其也被称为会飞的金属,请根据其性质回答下列问题:
(1)现在工业冶炼铝的化学方程式为 。
(2)铝锂合金是今年来航空金属材料中发展最为迅速的一个领域,主要因为合金的某些性能优于各成分金属,其中包括 、 等方面。同时铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,LiAlH4在化学反应中通常作
(填“氧化”或“还原”)剂。
(3)铝电池性能优越,在现代生产、生活中有广泛的应用。
①Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”),
②铝一空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。

该电池的负极反应方程式为 ;正极反应方程式为 ;
电池中NaCl溶液的作用是 ;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应式为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池中Zn为负极,发生还原反应
B.该电池的正极反应式为MnO2+e-+H2O=2MnOOH+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时内电路中OH-移动向MnO2一极
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上月考三化学试卷(解析版) 题型:填空题
重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示FeO·Cr2O3,还含有 SiO2、 Al2O3 等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:
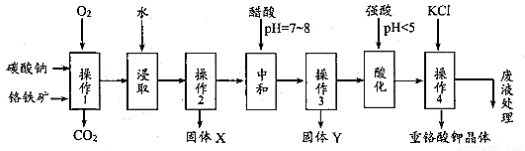
请回答下列问题:
操作1中发生的反应有:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
Na2CO3+Al2O3 2NaAlO2+CO2↑;Na2CO3+SiO2
2NaAlO2+CO2↑;Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
该步骤在常温下的反应速度较慢,为使反应速率增大,可采取的两条措施是____________。
(2)固体Y 中主要含有______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化,请写出离子反应方程式______________________。
(4)操作 4 中的化学反应在溶液中能发生的可能理由是_________________________;获得 K2Cr2O7 晶体的操作依次是:加入KCl 固体,在水浴上加热浓缩至______________,冷却结晶,抽滤,洗涤,干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:称取重铬酸钾试样 1.470g,用100mL 容量瓶配制成溶液。移取25.00mL 溶液于碘量瓶中,加入适里稀硫酸和足量碘化钾(铬的还原产物为 Cr3+),放于暗处 5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L 标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-;则所测产品中重铬酸钾的纯度为_____________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是_________.
A.粗产品若要进一步提纯,可以采用重结晶的方法
B. 配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上适应性训练四化学卷(解析版) 题型:实验题
【化学—选修5:有机化学基础】
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
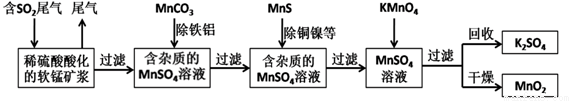
请回答下列问题:
(1)上述流程中多次设计到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯,_______________;其中玻璃棒的作用是___________________。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是_____________(只用文字表述)
(3)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式__________________。
(4)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(5)废气中SO2与稀硫酸酸化的软锰矿反应的化学方程式为_______________;已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3燃煤尾气,可得到硫酸锰晶体(MnSO4·H2O,相对分子质量为169)质量为_________________kg(结果保留3 位有效致字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com