
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
分析 C3H7FO可以看做丙烷中的2个H原子分别被1个F、1个-OH取代,丙烷只有一种结构,F与-OH可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子,据此书写判断.
解答 解:C3H7FO可以可知丙烷中的2个H原子分别被1个F、1个-OH取代,丙烷只有一种结构,F与-OH可以取代同一碳原子上的H原子,有2种:CH3CH2CH(OH)F、CH3CF(OH)CH3,可以取代不同碳原子上的H原子,有3种:HOCH2CH2CH2F、CH3CH(OH)CH2F、CH3CHFCH2OH,共有5种,故选B
点评 本题考查同分异构体的书写,难度中等,注意二元取代可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子.


科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:
有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题: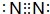 ;A单质及其最高价氧化物均属于原子晶体(填晶体类型)
;A单质及其最高价氧化物均属于原子晶体(填晶体类型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂白粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1mol/L该溶液和足量的Ca充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在25℃时,将cmol/L的醋酸溶液与0.02mol/LNaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) | |
| C. | 若将CO2 通入0.1 mol/LNaOH溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol/L | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | (NH4)2SO4 | NaHCO3 | Si | Fe2O3 |
| 用途 | 化肥 | 干燥剂 | 光电池 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
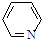 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| B. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
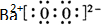 (写电子式),
(写电子式),查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com