
°æƒø°ø“ª∂®Œ¬∂»œ¬£¨‘⁄»˝∏ˆÃª˝æ˘Œ™2.0Lµƒ∫„»ð√б’»ð∆˜÷–∑÷±º”»Î“ª∂®¡øµƒX£¨∑¢…˙∑¥”¶£∫pX(g) ![]() Y(g)+Z(g)£¨œýπÿ ˝æð»Áœ¬±ÌÀ˘ æ£∫
Y(g)+Z(g)£¨œýπÿ ˝æð»Áœ¬±ÌÀ˘ æ£∫
»ð∆˜±ý∫≈ | Œ¬∂»(°Ê) | ∆ ºŒÔ÷ µƒ¡ø(mol) | ∆Ω∫‚ŒÔ÷ µƒ¡ø(mol) | |
X(g) | Y(g) | Z(g) | ||
¢Ò | 387 | 0.20 | 0.080 | 0.080 |
¢Ú | 387 | 0.40 | 0.160 | 0.160 |
¢Û | T | 0.20 | 0.090 | 0.090 |
ªÿ¥œ¬¡–Œ £∫
£®1£©»Ù»ð∆˜¢Ò÷–∑¥”¶æ≠10min¥ÔµΩ∆Ω∫‚£¨‘Ú«∞10minƒ⁄Yµƒ∆Ωæ˘∑¥”¶ÀŸ¬ v(Y)=___________°£»ð∆˜¢Ò∫Õ»ð∆˜¢Ú÷–∆ º ±Xµƒ∑¥”¶ÀŸ¬ v(X)¢Ò___________v(X)¢Ú(ÃÓ°∞¥Û”⁄°±°∞–°”⁄°±ªÚ°∞µ»”⁄°±)°£
£®2£©“—÷™∏√’˝∑¥”¶Œ™∑≈»»∑¥”¶£¨‘ÚT___________387(ÃÓ°∞¥Û”⁄°±ªÚ°∞–°”⁄°±)£¨≈–∂œ¿Ì”… «___________°£
£®3£©∑¥”¶∑Ω≥à Ω÷–XµƒªØ—ߺ∆¡ø ˝pµƒ»°÷µŒ™___________£¨»ð∆˜¢Ú÷–Xµƒ∆Ω∫‚◊™ªØ¬ Œ™___________°£»Ù∆ º ±œÚ»ð∆˜¢Ò÷–≥‰»Î0.1molX°¢0.15molY∫Õ0.10molZ£¨‘Ú∑¥”¶Ω´œÚ___________ (ÃÓ°∞’˝°±ªÚ°∞ƒÊ°±)∑¥”¶∑ΩœÚΩ¯––£¨≈–∂œ¿Ì”… «_____________________________________________________°£
°æ¥∞∏°ø 0.0040mol/(L°§min) –°”⁄ –°”⁄ œý∂‘”⁄»ð∆˜¢Ò£¨»ð∆˜¢Û∆Ω∫‚œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø£¨º¥ΩµµÕŒ¬∂»(ªÚ’˝∑¥”¶Œ™∑≈»»∑¥”¶£¨∆Ω∫‚œÚ∑≈»»∑¥”¶∑ΩœÚ“∆∂Ø£¨π Œ¬∂»ΩµµÕ) 2 80% ’˝ ∏˘æð»ð∆˜¢Ò÷– ˝æðø…º∆À„µ√µΩ387°Ê∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝Œ™4£¨ 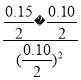 =1.5<4£¨À˘“‘∑¥”¶œÚ’˝∑¥”¶∑ΩœÚΩ¯––
=1.5<4£¨À˘“‘∑¥”¶œÚ’˝∑¥”¶∑ΩœÚΩ¯––
°æΩ‚Œˆ°ø ‘Â∑÷Œˆ£∫±æÂøº≤Ȫؗß∑¥”¶ÀŸ¬ ∫ժؗß∆Ω∫‚µƒº∆À„£¨Œ¬∂»°¢—π«ø∂‘ªØ—ß∆Ω∫‚µƒ”∞œÏ£¨ªØ—ß∆Ω∫‚≥£ ˝µƒ”¶”√°£
£®1£©»ð∆˜I÷–¶‘£®Y£©=![]() =0.0040mol/£®L°§min£©°£»ð∆˜I∫Õ»ð∆˜IIŒ¬∂»œýÕ¨£¨»ð∆˜II÷–Xµƒ∆ º≈®∂»Œ™»ð∆˜I÷–µƒ¡Ω±∂£¨‘Ú∆ º∑¥”¶ÀŸ¬ ¶‘£®X£©I–°”⁄¶‘£®X£©II°£
=0.0040mol/£®L°§min£©°£»ð∆˜I∫Õ»ð∆˜IIŒ¬∂»œýÕ¨£¨»ð∆˜II÷–Xµƒ∆ º≈®∂»Œ™»ð∆˜I÷–µƒ¡Ω±∂£¨‘Ú∆ º∑¥”¶ÀŸ¬ ¶‘£®X£©I–°”⁄¶‘£®X£©II°£
£®2£©∏√∑¥”¶µƒ’˝∑¥”¶Œ™∑≈»»∑¥”¶£¨…˝∏þŒ¬∂»∆Ω∫‚œÚƒÊ∑¥”¶∑ΩœÚ“∆∂Ø£ª»ð∆˜I∫Õ»ð∆˜IIIŒ¬∂»≤ªÕ¨£¨X∆ ºŒÔ÷ µƒ¡øœýÕ¨£¨∆Ω∫‚ ±»ð∆˜III÷–Y°¢ZŒÔ÷ µƒ¡ø¥Û”⁄»ð∆˜I÷–£¨»ð∆˜IIIœý∂‘”⁄»ð∆˜I∆Ω∫‚œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø£¨‘ÚT–°”⁄387°£
£®3£©»ð∆˜II∫Õ»ð∆˜IŒ¬∂»œýÕ¨£¨»ð∆˜II÷–X∆ ºŒÔ÷ µƒ¡øŒ™»ð∆˜I÷–µƒ¡Ω±∂£¨»ð∆˜IIœýµ±”⁄‘⁄»ð∆˜Iª˘¥°…œΩ´Ãª˝Àı–°Œ™‘≠¿¥µƒ“ª∞Σ¨∆Ω∫‚ ±»ð∆˜II÷–Y°¢ZŒÔ÷ µƒ¡øŒ™»ð∆˜I÷–µƒ¡Ω±∂£¨º¥‘ˆ¥Û—π«ø£¨∆Ω∫‚≤ª“∆∂Ø£¨‘Úp=1+1=2°£∑¥”¶µƒ∑Ω≥Ã ΩŒ™2X£®g£©![]() Y£®g£©+Z£®g£©£¨‘Ú»ð∆˜II…˙≥…0.160molYœ˚∫ƒ0.320molX£¨»ð∆˜II÷–Xµƒ∆Ω∫‚◊™ªØ¬ Œ™
Y£®g£©+Z£®g£©£¨‘Ú»ð∆˜II…˙≥…0.160molYœ˚∫ƒ0.320molX£¨»ð∆˜II÷–Xµƒ∆Ω∫‚◊™ªØ¬ Œ™![]() 100%=80%°£»ð∆˜I÷–…˙≥…0.080molYœ˚∫ƒ0.160molX£¨»ð∆˜I∆Ω∫‚ ±X°¢Y°¢ZŒÔ÷ µƒ¡ø“¿¥ŒŒ™0.04mol°¢0.08mol°¢0.08mol£¨∆Ω∫‚ ±X°¢Y°¢ZŒÔ÷ µƒ¡ø≈®∂»“¿¥ŒŒ™0.02mol/L°¢0.04mol/L°¢0.04mol/L£¨387°Ê ±∑¥”¶µƒªØ—ß∆Ω∫‚≥£ ˝K=
100%=80%°£»ð∆˜I÷–…˙≥…0.080molYœ˚∫ƒ0.160molX£¨»ð∆˜I∆Ω∫‚ ±X°¢Y°¢ZŒÔ÷ µƒ¡ø“¿¥ŒŒ™0.04mol°¢0.08mol°¢0.08mol£¨∆Ω∫‚ ±X°¢Y°¢ZŒÔ÷ µƒ¡ø≈®∂»“¿¥ŒŒ™0.02mol/L°¢0.04mol/L°¢0.04mol/L£¨387°Ê ±∑¥”¶µƒªØ—ß∆Ω∫‚≥£ ˝K=![]() =4£¨¥À ±µƒ≈®∂»…ÃŒ™
=4£¨¥À ±µƒ≈®∂»…ÃŒ™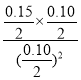 =1.5<4£¨À˘“‘∑¥”¶œÚ’˝∑¥”¶∑ΩœÚΩ¯––°£
=1.5<4£¨À˘“‘∑¥”¶œÚ’˝∑¥”¶∑ΩœÚΩ¯––°£



| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™X°¢Y°¢Z°¢Wæ˘Œ™÷–—ߪؗß÷–≥£º˚µƒµ•÷ ªÚªØ∫œŒÔ£¨À¸√«÷ƺ‰µƒ◊™ªØπÿœµ»ÁÕºÀ˘ æ(≤ø∑÷≤˙ŒÔ“—¬‘»•)°£‘ÚW°¢X≤ªø…ƒÐ «
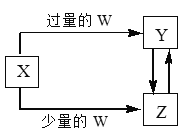
—°œÓ | W | X |
A | —ŒÀ· | úÀ·ƒ∆»Ð“∫ |
B | «‚—ıªØƒ∆»Ð“∫ | ¬»ªØ¬¡»Ð“∫ |
C | ∂˛—ıªØú | «‚—ıªØ∏∆»Ð“∫ |
D | ¬»∆¯ | Ã˙µ•÷ |
A. A B. B C. C D. D
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–ŒÔ÷ æ√÷√ø’∆¯÷–≤ªª·±‰÷ µƒ «£®°°°°£©
A.–¬÷∆¬»ÀÆ
B.∆Ø∞◊∑€
C.π˝—ıªØƒ∆∑€ƒ©
D.¬»ªØƒ∆πÃÃÂ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øÃ˙ «»À¿ýΩœ‘Á π”√µƒΩ Ù÷Æ“ª°£‘À”√Ã˙º∞∆‰ªØ∫œŒÔ”–πÿ÷™ ∂£¨ªÿ¥œ¬¡–Œ £∫
£®1£©Ã˙‘⁄“ª∂®Ãıº˛œ¬£¨ø…”ÎÀÆ’Ù∆¯∑¥”¶–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥à Ω______________________________
£®2£©œÚ∑–ÀÆ÷–÷µŒµŒº”1 mol°§L£≠1FeCl3»Ð“∫£¨÷¡“∫ÃÂ≥ Õ∏√˜µƒ∫Ï∫÷…´£¨∏√∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™________________________________
£®3£© ∫∏Ω”∏÷Ã˙ ±≥£”√µƒ∫∏“©Œ™¬»ªØÔߣ¨◊˜”√ «œ˚≥˝∫∏Ω”¥¶µƒÃ˙–‚£®≥…∑÷ «Fe2O3£©°£∑¢…˙∑¥”¶µƒÃÂœµ÷–π≤”–¡˘÷÷ŒÔ÷ £∫NH4Cl°¢FeCl3°¢N2°¢Fe2O3°¢Fe∫ÕX°£
¢Ÿ–¥≥ˆ≤¢≈‰∆Ω∏√∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫_________________________________
¢⁄∑¢…˙—ıªØ∑¥”¶µƒŒÔ÷ «________£¨∑¥”¶÷–”–4 molµƒFe2O3≤Œ”Î∑¥”¶ƒÐ________ (ÃÓ°∞ ß»•°±ªÚ°∞µ√µΩ°±)________ molµÁ◊”°£
¢€∑¥”¶÷–≤˙…˙¡À11.2 L(±Í◊º◊¥øˆ)µƒ∆¯Ã ±£¨±ªªπ‘≠µƒŒÔ÷ µƒ÷ ¡øŒ™_____°£
£®4£©∏þÃ˙À·ƒ∆Na2FeO4 «“ª÷÷–¬–ÕæªÀƺ¡°£
¢Ÿ∏þÃ˙À·ƒ∆÷˜“™Õ®π˝»Áœ¬∑¥”¶÷∆»°£∫2Fe(OH)3£´3NaClO£´4NaOH===2Na2FeO4£´3X£´5H2O£¨‘ÚXµƒªØ—ß ΩŒ™___________°£
¢⁄œ¬¡–ŒÔ÷ ƒÐ◊˜æªÀƺ¡£®ƒÐ≥˝»•ÀÆ÷–µƒ–¸∏°ŒÔ£©µƒ”–____________°£
A.[KAl(SO4)2°§12H2O] B£ÆAl(OH)3 Ω∫ÃÂ
C£ÆClO2 D£Æ°∞84°±œ˚∂æ“∫
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™∑¥”¶£∫HCl + NH3= NH4Cl£®πÃã©»Áœ¬ÕºÀ˘ 棨≥È»•◊∞÷√÷–µƒ≤£¡ß∆¨£¨ π¡Ω÷÷∆¯ÃÂ≥‰∑÷∑¥”¶£®’˚∏ˆπ˝≥Ã÷–»œŒ™◊∞÷√∆¯√Ж‘¡º∫√£©£¨µ»Œ¬∂»ª÷∏¥µΩ‘≠¿¥Œ¬∂»°£œ¬¡–Àµ∑®’˝»∑µƒ «£® £©
![]()
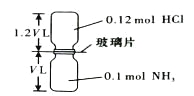
A. ∑¥”¶∫Û∆øƒ⁄—π«ø «∑¥”¶«∞µƒ1/10 B. ◊∞÷√÷–«‚‘™Àÿµƒ◊Ð÷ ¡øŒ™0.42 g
C. …˙≥…ŒÔµƒ∑÷◊” ˝ƒøŒ™0.1 NA D. ∑¥”¶Ω· ¯∫Û£¨¡Ω∏ˆºØ∆¯∆ø∫лð“◊∑÷ø™
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥ªØ—ß—–æø–°◊ÈÃΩæøÕ‚ΩÁÃıº˛∂‘ªØ—ß∑¥”¶mA(g)+nB(g)![]() pC(g)µƒÀŸ¬ ∫Õ∆Ω∫‚µƒ”∞œÏÕºœÒ»Áœ¬£¨œ¬¡–≈–∂œ’˝»∑µƒ «
pC(g)µƒÀŸ¬ ∫Õ∆Ω∫‚µƒ”∞œÏÕºœÒ»Áœ¬£¨œ¬¡–≈–∂œ’˝»∑µƒ «

A. ”…Õº1ø…÷™£¨T1<T2£¨∏√∑¥”¶’˝∑¥”¶Œ™Œ¸»»∑¥”¶
B. ”…Õº2ø…÷™£¨∏√∑¥”¶m+n<p
C. Õº3÷–£¨µ„3µƒ∑¥”¶ÀŸ¬ V’˝>VƒÊ
D. Õº4÷–£¨»Ùm+n=p£¨‘Úa«˙œþ“ª∂® π”√¡À¥þªØº¡
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø Ø”Õ≤˙∆∑÷–∫¨”–H2Sº∞COS°¢CH3SHµ»∂ý÷÷”–ª˙¡Ú£¨ ؔժØπ§¥þ…˙≥ˆ∂ý÷÷Õ—¡Úºº ı°£«Îªÿ¥œ¬¡–Œ £∫
£®1£©COSµƒµÁ◊” Ω «_______________°£
£®2£©“—÷™»»ªØ—ß∑Ω≥Ã Ω£∫¢Ÿ2H2S(g)+SO2(g)=3S(s)+2H2O(l) °˜H=-362kJ°§mol-1
¢⁄2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) °˜H2=-1172kJ°§mol-1
‘ÚH2S∆¯ÃÂ∫Õ—ı∆¯∑¥”¶…˙≥…πÃè¡Ú∫Õ“∫èÀƵƒ»»ªØ—ß∑Ω≥Ã ΩŒ™__________________°£
£®3£©ø…“‘”√K2CO3»Ð“∫Œ¸ ’H2S£¨∆‰‘≠¿ÌŒ™K2CO3+H2S=KHS+KHCO3£¨∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝Œ™________°£(“—÷™H2CO3µƒKa1=4.2°¡10-7£¨Ka2=5.6°¡10-11£ªH2SµƒKa1=5.6°¡10-8£¨Ka2=1.2°¡10-15)
£®4£©‘⁄«øÀ·»Ð“∫÷–”√H2O2ø…Ω´COS—ıªØŒ™¡ÚÀ·£¨’‚“ª‘≠¿Ìø…”√”⁄COSµƒÕ—¡Ú°£∏√∑¥”¶∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™_________________°£
£®5£©COSµƒÀÆΩ‚∑¥”¶Œ™COS(g)+H2O(g)![]() CO2(g)+H2S(g) °˜H<0°£ƒ≥Œ¬∂» ±£¨”√ªÓ–‘¶¡-Al2O3◊˜¥þªØº¡£¨‘⁄∫„»ð√б’»ð∆˜÷–COS(g)µƒ∆Ω∫‚◊™ªØ¬ ÀÊ≤ªÕ¨Õ∂¡œ±»[n(H2O)/n(COS)]µƒ◊™ªØπÿœµ»ÁÕº1À˘ æ°£∆‰À¸Ãıº˛œýÕ¨ ±£¨∏ƒ±‰∑¥”¶Œ¬∂»£¨≤‚µ√“ª∂® ±º‰ƒ⁄COSµƒÀÆΩ‚◊™ªØ¬ »ÁÕº2À˘ æ£∫
CO2(g)+H2S(g) °˜H<0°£ƒ≥Œ¬∂» ±£¨”√ªÓ–‘¶¡-Al2O3◊˜¥þªØº¡£¨‘⁄∫„»ð√б’»ð∆˜÷–COS(g)µƒ∆Ω∫‚◊™ªØ¬ ÀÊ≤ªÕ¨Õ∂¡œ±»[n(H2O)/n(COS)]µƒ◊™ªØπÿœµ»ÁÕº1À˘ æ°£∆‰À¸Ãıº˛œýÕ¨ ±£¨∏ƒ±‰∑¥”¶Œ¬∂»£¨≤‚µ√“ª∂® ±º‰ƒ⁄COSµƒÀÆΩ‚◊™ªØ¬ »ÁÕº2À˘ æ£∫

¢Ÿ∏√∑¥”¶µƒ◊Óº—Ãıº˛Œ™:Õ∂¡œ±»[n(H2O)/n(COS)]____£¨Œ¬∂»_____________
¢⁄Pµ„∂‘”¶µƒ∆Ω∫‚≥£ ˝Œ™_____________°£(±£¡Ù–° ˝µ„∫Û2Œª)
¢€µ±Œ¬∂»…˝∏þµΩ“ª∂®÷µ∫Û£¨∑¢œ÷“ª∂® ±º‰ƒ⁄COS(g)µƒÀÆΩ‚◊™ªØ¬ ΩµµÕ£ª≤¬≤‚ø…ƒÐµƒ‘≠“Ú «__________________°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–—ŒµƒÀƻГ∫≥ À·–‘µƒ «( )
A.NaClB.Na2CO3C.CH3COONaD.AlCl3
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–∏˜◊È÷–µƒ¿Î◊”£¨ƒÐ‘⁄»Ð“∫÷–¥Û¡øπ≤¥Êµƒ «£®°°°°£©
A.Na+°¢H+°¢Cl©Å°¢HCO3©Å
B.K+°¢Fe3+°¢NO3©Å°¢SO42©Å
C.Ca2+°¢H+°¢C1©Å°¢OH©Å
D.Na+°¢Ba2+°¢CO32©Å°¢NO3©Å
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com