
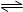 2SO3(g) + 197 kJʵ�����й��������£�
2SO3(g) + 197 kJʵ�����й��������£�| ������� | ��ʼʱ�����ʵ����ʵ��� / mol | �ﵽƽ��ʱ��ϵ�����ı仯/KJ | ||
| SO2 | O2 | SO3 | ||
| �� | 2 | 1 | 0 | �ų�������Q1 |
| �� | 1.8 | 0.9 | 0.2 | �ų�������Q2 |


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H++Cl-+HClO������˵������ȷ����(����)
H++Cl-+HClO������˵������ȷ����(����)| A������һ��ʱ���,c(HClO)��С |
| B������̼��Ʒ�ĩ��,��Һ��pH����,�������HClOŨ�� |
| C����������ˮ,��ˮ�����c(H+)��С |
D����������NaOH����,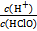 ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NO2(g)����H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����( )
2NO2(g)����H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����( )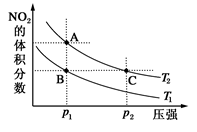
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʵ�������ű���ʳ��ˮ�ķ����ռ����� |
| B����Ũ������KBr��Ӧ�Ʊ�HBr���� |
| C������FeSO4��Һʱ������һЩ���� |
| D���ڸ����HCl���������MgCl2��6H2O���壬�õ���ˮMgCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
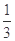 Fe2O3��s��+ CO��g��
Fe2O3��s��+ CO��g�� 
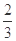 Fe��s��+CO2��g��+Q
Fe��s��+CO2��g��+Q| �¶�/�� | 1000 | 1115 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� ��� | ��ʼʱ���������ʵ�����mol | ��ƽ�������ϵ | |||
| CO | H2O | CO2 | H2 | �����ı仯 | |
| �� | 1 | 4 | 0 | 0 | �ų�������32.8 kJ |
| �� | 0 | 0 | 1 | 4 | �����仯��Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 xC(g) ��H��0�����������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g) ��H��0�����������c(A)��ʱ��t�ı仯��ͼ��ʾ��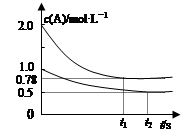
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)������ʼʱֻ����2a mol NH3���ﵽƽ��ʱ����������ѹǿ����ʼʱ������40%����ͬ�����¿�ʼʱ����a mo N2��3a mol H2�Ļ�����壬��
2NH3(g)������ʼʱֻ����2a mol NH3���ﵽƽ��ʱ����������ѹǿ����ʼʱ������40%����ͬ�����¿�ʼʱ����a mo N2��3a mol H2�Ļ�����壬�� 2NH3(g)������ʼʱֻ����2a mol NH3���ﵽƽ��ʱ����������ѹǿ����ʼʱ������40%������ʼʱ����a mo N2��3a mol H2�Ļ�����壬��
2NH3(g)������ʼʱֻ����2a mol NH3���ﵽƽ��ʱ����������ѹǿ����ʼʱ������40%������ʼʱ����a mo N2��3a mol H2�Ļ�����壬���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2����������Ľ����
2NH3������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2����������Ľ����| A��ƽ�ⲻ�����ƶ����� | B��ƽ�������淴Ӧ�����ƶ� |
| C�����淴Ӧ���ʶ����� | D��NH3�������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com