
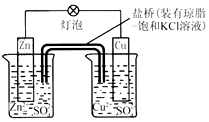
| A. | 负极反应为:2n-2e -═2n2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 盐桥中酌K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
分析 锌、铜和硫酸铜、硫酸锌组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上铜离子得电子发生还原反应;电子从负极沿导线流向正极;阳离子移向正极,阴离子移向负极.
解答 解:A、锌、铜和硫酸铜、硫酸锌组成的原电池中,锌作负极,负极上锌失电子发生氧化反应,反应为:Zn-2e -═Zn2+,故A正确;
B、锌、铜和硫酸铜、硫酸锌组成的原电池中,锌作负极,铜作正极,电池反应为:Zn+Cu2+═Zn2++Cu,故B正确;
C、盐桥中的K+移向正极CuSO4溶液,故C错误;
D、锌、铜和硫酸铜、硫酸锌组成的原电池中,电子从负极沿导线流向正极,故D正确;
故选C.
点评 本题考查学生原电池的工作原理,注意把握正负极的判断、电极方程式的书写、电子流向等,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未用待测溶液润洗 | |
| B. | 碱式滴定管未用待装溶液润洗 | |
| C. | 锥形瓶未用待装溶液润洗 | |
| D. | 在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 铜丝插入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO粉尘 | B. | Fe3O4粉尘 | C. | Fe2O3粉尘 | D. | NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验法 | B. | 分类法 | C. | 观察法 | D. | 比较法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
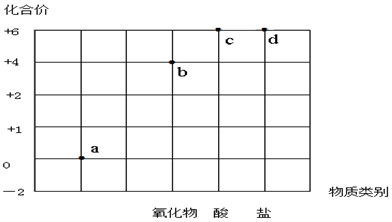
| A. | a点表示的物质所属的物质类别是单质 | |
| B. | b点表示的物质可以是SO2或SO3 | |
| C. | c点表示的化合物的浓溶液可作为干燥剂 | |
| D. | d点表示的可溶性物质能与BaCl2溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的水中水分子数为0.5NA | |
| B. | 通常状况下,0.5NA个氮分子占有的体积为11.2L | |
| C. | 1molH2和O2的混合气体中含2NA个分子 | |
| D. | 0.1mol的OH-中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
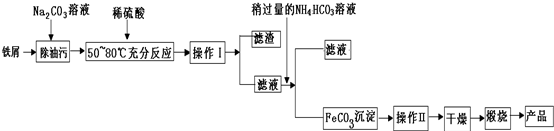
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com