
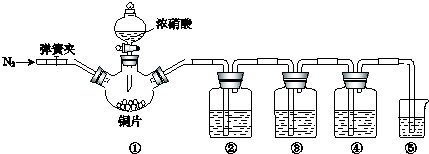
| 实验过程 | 实验现象 |
| Ⅰ.检验装置的气密性 | \ |
| Ⅱ.… | \ |
| Ⅲ.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、氯化钠溶液在电流作用下电离成氯离子和钠离子 |
| B、溶于水后电离出氢离子的化合物都是酸 |
| C、硫酸钡难溶于水但硫酸钡是强电解质 |
| D、氨气溶于水能部分电离,故氨气属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | 质量(g) | 摩尔质量(g?mol-1) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na+2H2O═2NaOH+H2↑ | ||||
B、C+H2O(g)
| ||||
| C、CaO+H2O═Ca(OH)2 | ||||
| D、Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
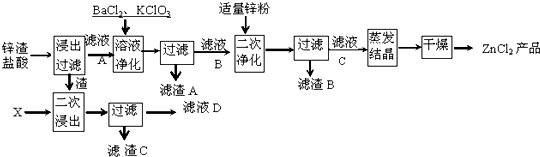
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |
| ② | 20mL 0.2mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:
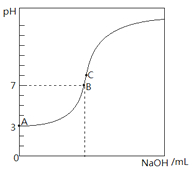 常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )
常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )| A、由图可知HA是一种弱酸,且Ka=1.0×10-5 |
| B、滴定到B点时,c(Na+)=c(A-) |
| C、当NaOH溶液的体积为10.00mL时,有c(A-)+c(OH-)=c(H+)+c(HA) |
| D、C点溶液中的离子浓度关系为:c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 mL |
| B、40mL |
| C、30 mL |
| D、15 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
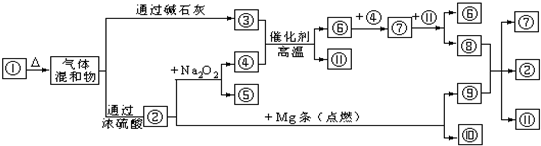
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com