
【题目】某工业废液里含有FeCl2、CuCl2和FeCl3 . 为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程: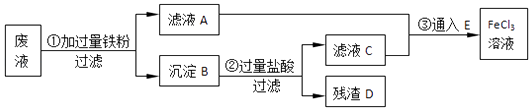
(1)A的化学式为 , E的化学式为 .
(2)B的化学成份 , 回收的铜是(填A、B、C、D或E).
(3)根据图示,反应②的化学方程式为 .
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一氧化氮与过氧化钠反应可以制备亚硝酸钠,反应方程式为:2NO+Na2O2→2NaNO2。一氧化氮可由木炭、浓硝酸、水和铜为原料制备。实验装置图下图所示(部分夹持装置略)。
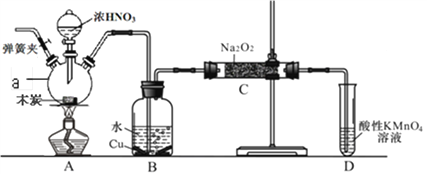

已知:室温下,①3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;
②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)仪器a的名称_________;
(2)写出浓硝酸与木炭反应的化学方程式___________________________________。
(3)B中观察到的主要现象是_____________________________________________。
(4)D装置的作用是______________________________;D中发生反应的离子方程式____________。
(5)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和______,为避免产生这些副产物应在B、C装置间增加装置_______(填入“E”或“F”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表没食子儿茶素没食子酸酯(EGCG)是中国绿茶中主要的活性成份,下列说法正确的是

A. 分子式为C22H20O11
B. 分子只有1个手性碳原子
C. 分子易发生氧化反应,因此绿茶具有抗氧化性
D. 1mol该化合物与足量的NaOH溶液反应,最多消耗10molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验方法正确的是( )
A.用铜片和浓硝酸反应制NO
B.加热NH4Cl和Ca(OH)2固体混合物制取NH3
C.用浓硫酸干燥NH3
D.用排水法收集NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活处处有化学.下列叙述正确的有( )
A.大米经蒸煮和发酵可酿造白酒
B.油脂水解的最终产物为葡萄糖
C.棉花和蚕丝的主要成分都是纤维素
D.豆制品中的主要营养物质是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构简式如图,则此有机物可发生的反应类型有( )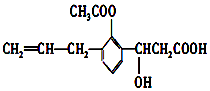
①取代 ②加成 ③消去④酯化⑤水解⑥氧化⑦中和 ⑧加聚.
A.①②③⑤⑥
B.②③④⑤⑥⑧
C.②③④⑤⑥⑦
D.①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼位于ⅢA族,三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②![]() ;③硼能与氢氧化钠溶液反应(与铝性质相似)。
;③硼能与氢氧化钠溶液反应(与铝性质相似)。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼

(1)常温下,高锰酸钾固体和浓盐酸反应可以代替A装置中的反应,请写出高锰酸钾固体与浓盐酸反应的离子方程式___________________________________。
(2)E装置的作用是______________________;如果拆去B装置,可能后果是___________________。
(3)实验中可以用一个盛装____________(填试剂名称)的干燥管代替F和G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:___________。
(5)为了顺利完成实验,正确的操作是_______(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯;②先点燃D处酒精灯,后点然A处酒精灯;③同时点燃A, D处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓_________(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列叙述不正确的是
A.铁路建设所需的大量水泥属于新型无机非金属材料
B.豆科植物根瘤菌可以在常温常压下把氮气转化为氮的化合物
C.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D.自来水中通入氯气用来杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
(6)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com