
【题目】化合物X由两种元素组成,为探究其组成和性质,设计并完成如下实验:
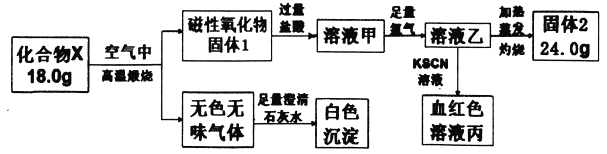
请回答:
(1)X的化学式是________。
(2)溶液甲与足量氯气反应的离子方程式为____________。
(3)加热条件下氨气被固体2氧化成一种气体单质,写出该反应的化学方程式_________。
【答案】 Fe3C 2Fe2++ Cl2= 2Fe3++ 2Cl- 2NH3+Fe2O3![]() N2+3H2O+2Fe
N2+3H2O+2Fe
【解析】本题考查实验方案设计与评价,(1)磁性氧化物是Fe3O4,说明X中含有Fe元素,根据流程图,固体2为Fe2O3,根据元素和原子守恒,化合物X中Fe的物质的量为24×2/160mol==0.3mol,无色无味气体能使澄清石灰水变浑浊,因此此气体为CO2,说明化合物中X中含有C,化合物X中C的质量为(18.0-0.3×56)g=1.2g,C的物质的量为1.2/12mol=0.1mol,即X的化学式为Fe3C;(2)磁性氧化物Fe3O4与盐酸反应Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,根据流程图,溶液甲中含有Fe3+和Fe2+,加入氯气,发生的离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;(3)NH3被Fe2O3氧化成一种气体单质,即N转化成N2,铁元素被还原成铁单质,即化学反应方程式为:2NH3+Fe2O3![]() N2+3H2O+2Fe。
N2+3H2O+2Fe。


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是()
A. 能电离出离子的化合物都是离子化合物
B. 熔融状态下能导电的化合物一定是离子化合物
C. 不同元素组成的多原子分子里的化学键一定是极性键
D. 非金属元素构成的单质中一定存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,有①6.72LCH4,②3.01×1023个HCl,③13.6gH2S ,④0.2molNH3,则下列四种气体的关系表示正确的是()
A. 体积:④<①<②<③ B. 密度:①<③<④<②
C. 质量:④<①<③<② D. 氢原子数:②<③<④<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.毛发和蚕丝的主要成分都是蛋白质
B.天然气和沼气的主要成分都是甲烷
C.油脂氢化、氨基酸形成多肽、蛋白质水解都属于取代反应
D.乙烯、苯乙烯均可发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂周围的空气含有较多二氧化硫,某化学兴趣小组设计了以下装置和方法测定空气(内含N2、O2、SO2、CO2等)中SO2含量。
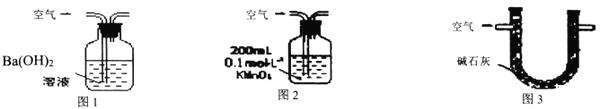
甲.用图1所示装置,通入V升空气,测定生成沉淀的质量
乙.用图2所示装置,当KMnO4溶液刚好褪色时,测定通入空气的体积V
丙.用图3所示装置,通入V升空气,测定U型管增加的质量
(1)你认为可行的操作是________。(填“甲、乙、丙”)
(2)某环保部门为了测定空气中SO2含量,做了如下实验:取标准状况下的空气VL,缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①若通入气体的速率过快,则测定的SO2的体积分数_______。(选填“偏高”、“偏低”或“不受影响”)。
②如何判断氯化钡溶液已经加过量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列电解质在水溶液中的电离方程式
NaHCO3__________________________
HCl____________________________
CH3COOH_________________________
Fe(OH)3_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 HO-CH2CH=CHCH2-COOH ,该有机物不可能发生的化学反应是 ( )
A. 水解B. 酯化C. 加成D. 氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com