
【题目】已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8,将amolL-1NaHSO3溶液与bmolL-1NaOH溶液等体积混合(a>0,b>0),混合所得溶液中微粒的物质的量浓度关系正确的是
A.a=b时:c(OH-)=c(H+)+c(HSO3-)
B.a=3b时:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.当溶液pH=7时:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.若4c(Na+)=5c(SO32-)+5c(HSO3-)+5c(H2SO3),则a=4b
【答案】D
【解析】
A.a=b时,反应后的溶质是Na2SO3,根据质子守恒进行判断;
B. a=3b时,反应后的溶质是Na2SO3和NaHSO3,两者物质的量之比为1:2,根据电荷守恒进行分析判断;
C.当溶液pH=7时,由K2= 判断离子浓度大小关系;
判断离子浓度大小关系;
D.由物料守恒进行分析和判断。
A..a=b时,反应后的溶质是Na2SO3,根据质子守恒有:c(OH-)=c(H+)+c(HSO3-)+2c(SO32-),A项错误;
B. a=3b时,反应后的溶质是Na2SO3和NaHSO3,两者物质的量之比为1:2,根据电荷守恒有:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),B项错误;
C. 当溶液pH=7时,由K2= =6.2×10-8,则
=6.2×10-8,则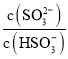 =0.62,即:c(HSO3-)>c(SO32-),C项错误;
=0.62,即:c(HSO3-)>c(SO32-),C项错误;
D.由物料守恒可知:若4c(Na+)=5c(SO32-)+5c(HSO3-)+5c(H2SO3),则a=4b,D项正确;
答案选D。


科目:高中化学 来源: 题型:
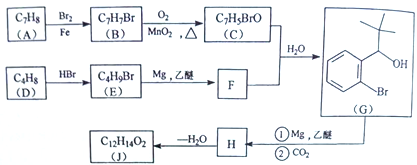
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
己知: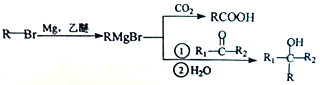
(1)G中官能团的名称为_________、_________。
(2)D的系统命名是_________。
(3)由A生成B的化学方程式为_________,反应类型_________。
(4)C与银氨溶液反应的化学方程式为________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_________。
(6)写出一种同时满足下面条件的G的同分异构体的结构简式_________。
①核磁共振氢谱有4组峰②能与FeCl3溶液发生显色反应
(7)借助题中信息写出以乙醛和苯为原料,合成 的路线流程图(其它试剂自选)。_________________________________________________________。
的路线流程图(其它试剂自选)。_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g)![]() CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的![]() ,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.C5H10共有8种同分异构体(不考虑立体异构)
B. 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C.CH3COOCH2CH3 和CH3CH2COOCH3互为同分异构体
D.苯甲醇和苯酚互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.

![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=﹣870.3 kJ·mol-1
③ C(s)+O2(g)=CO2(g)ΔH2=﹣393.5 kJ·mol-1
④ H2(g)+![]() O2(g)=H2O(l)ΔH3=﹣285.8 kJ·mol-1
O2(g)=H2O(l)ΔH3=﹣285.8 kJ·mol-1
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.﹣870.3 kJ·mol-1B.﹣571.6 kJ·mol-1
C.+787.0 kJ·mol-1D.﹣488.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,采用以下路线合成X。
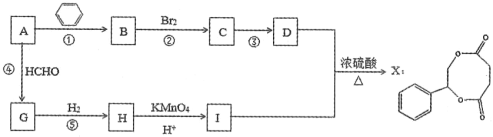
已知:RC≡CH+HCHO![]() RC≡CCH2OH
RC≡CCH2OH
请回答下列问题:
(1)若反应①、②、④的原子利用率均为100%,则A的名称为:________。
(2)物质G的结构简式为:_________。
(3)写出反应③的化学反应方程式:_________。
(4)物质E是D催化氧化后生成的有机产物,E能发生银镜反应,写出E中官能团名称:________。
(5)物质H和物质I可以在一定条件下合成链状聚合物,请写出化学方程式:______。
(6)符合下列条件的D的同分异构体共有_______种,写出其中一种的结构简式_____。
i.与FeCl3溶液能发生显色反应 ii.苯环上的一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C是中学化学中最常见的三种有机物,D是高分子化合物,常用来制造食品和药品包装袋,已知这四种物质之间存在如图所示关系:
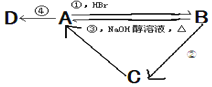
(1)写出反应类型:①___,③____,④____。
(2)反应②的条件是____。
(3)写出化学方程式:B→C:___,A→D:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com