
| A. | RO4- | B. | RO3- | C. | RO42- | D. | RO5- |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性, |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 木炭在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
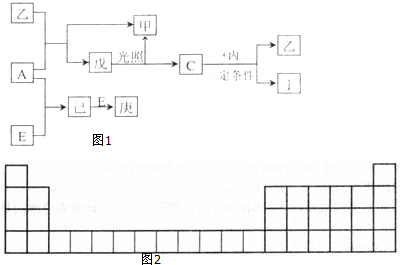
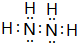 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 在元素周期表里,元素所在的周期序数等于原子核外电子层数 | |
| C. | 最外层电子数为8的粒子是稀有气体元素的原子 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
| A. | 小于0.8 | B. | 大于1.2 | C. | 在0.8与1.2之间 | D. | 在0.8与1.5之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 △H=+88.6kJ•mol-1则M、N相比,较稳定的是M.
△H=+88.6kJ•mol-1则M、N相比,较稳定的是M.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 纯水中水的电离:2H2O?H3O++OH- | |
| C. | 氢硫酸的电离:H2S?2H++S2- | |
| D. | 氯化铁和硫氰化钾反应:Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种难溶盐电解质,其中Ksp小的溶解度一定小 | |
| B. | 溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 | |
| C. | 难溶盐电解质的Ksp与温度有关 | |
| D. | 同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com