
用酸性KMnO4溶液不能达到 预期目的的是
预期目的的是
A.区别苯和甲苯 B.检验硫酸铁溶液中是否有硫酸亚铁
C.检验CH2=CHCHO中含碳碳双键 D.区别SO2和CO2
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
已知X2、Y2、Z2、W2四种物质的氧化能力强弱顺序为:W2>Z2>X2>Y2,判断下列氧化还原反应,能够发生的是( )
A.2W-+Z2===2Z-+W2 B.2X-+Y2===2Y-+X2
C.2Y-+W2===2W-+Y2 D.2Z-+X2===2X-+Z2
查看答案和解析>>
科目:高中化学 来源: 题型:
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。

(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式: (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体的叙述中,正确的是( )
A、 在Si晶体中,Si原子与Si-Si键之比为1:4
B、在NaCl晶体中,每个Na+周围距离最近的Na+有6个
C、在CsCl晶体中,与每个Cs+紧邻的Cs+有8个
D、在面心立方堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
⑶若XM3最初水解产物是XH3和HMO,则X、M元素的电负性大小顺序是:X_____M((填>、<、或=);若已知磷与M元素电负性关系是:P<M,则PM3水解的化学反应方程式是 。
(4)已知QM3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,则QM3是_________(填“离子化合物”或“共价化合物”),如何通过实验判别__________________。在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,则QM3的结构式为_________。
(5)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列 表示对应化学反应的离子方程式正确的是
表示对应化学反应的离子方程式正确的是
A.用白醋除铁锈:Fe2O3+6H+===3H2O+2Fe3+
B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:
Ba2++ 2OH-+NH + HCO
+ HCO
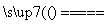 NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
C.用过量冷氨水吸收SO2:SO2+NH3·H2O===HSO +NH
+NH
D. 用强碱吸收工业制取硝酸尾气:NO+ NO2+2OH-===2NO +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
 |
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时 发生反应的化学方程式: 。
发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
②K、Na合金可作原子反应堆的导热剂
③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等
⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂
A.①②③④ B.②③④⑤ C.①②③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式错误的是
A.测得0.1 mol·L-1氨水的pH为11:NH3·H2O NH4+ +OH-
NH4+ +OH-
B.将Na块投入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl-
Cu2++2Cl-
D.将1 mol·L-1FeCl3溶液滴入沸水中,得到透明红褐色液体:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com