
����ʵ����Ʒ����У����е���
A���ü������CuCl2��Һ���ٹ��ˣ���ȥCu(NO3)2��Һ�л��е�AgNO3
B��ij�����ڼ���ϡ�����������ɫ��ζ����ʹ����ʯ��ˮ����ǵ����壬֤���ù���һ������CO32-
C����ij��ɫδ֪��Һ�н�����BaCl2��Һ���Լ���δ֪��Һ�е�SO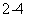





 D���Ⱥ�μ���ɫʯ����Һ��BaCl2��Һ�����Խ����ᡢ�������ơ������ơ��������ƺ������������ɫ��Һ����
D���Ⱥ�μ���ɫʯ����Һ��BaCl2��Һ�����Խ����ᡢ�������ơ������ơ��������ƺ������������ɫ��Һ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£�������Һ���й����ʵ���Ũ�ȹ�ϵ�ͼ��㲻��ȷ���ǣ� ��
A��c(NH4+)��ȵ�(NH4)2SO4��(NH4)2Fe(SO4)2��NH4Cl��Һ�У�����Ũ�ȴ�С��ϵ�ǣ�
c(NH4Cl) ��c[(NH4)2SO4]��c[(NH4)2Fe(SO4)2]
B����֪25��CʱKsp(AgCl)=1.8��10-10������0.1mol��L-1AlCl3��Һ�У�Ag+�����ʵ���Ũ�����ɴﵽ6.0��10-10mol��L-1
C��0.2mol��L��1 HCl��Һ������0.05 mol��L��1 Ba(OH)2��Һ��Ϻ���Һ��pHԼΪ1
D�������£�0.1mol��L-1NaHA��Һ��pH=4������C(HA-) ��C(H+)��C��A2-����C(H2A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A����NaOH��Һ�������μ�FeCl3������Һ�����Ƶ�Fe(OH)3����
B��������������ɢϵ�ı��������ǽ����ܷ��������ЧӦ
C����ȥFe(OH)3�����е�Na����Cl�����ù��˵ķ���
D��Fe(OH)3��������μ���ϡ���ᣬ�����������������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����������Һ�м����������ʱ������Ӧ��4Fe2����4Na2O2��6H2O===4Fe(OH)3����O2����8Na�� ������˵����ȷ����
A���÷�Ӧ�л�ԭ��ΪFe2����O2��Fe(OH)3��Ϊ��������
B����ַ�Ӧ����Կ�����ɫ��������������
C����״���£�ÿ����22.4 L O2������4 mol Na2O2����ԭ
D������4 mol Na2O2�μӷ�Ӧ����Ӧ�й�ת��6NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ������������ԣ���
���Ʊ�����ѡ�õ�ҩƷΪ����������̺�Ũ���ᣬ����صĻ�ѧ��Ӧ����ʽΪ�� �� ��
װ��B�б���ʳ��ˮ��������_____�� ____��ͬʱװ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е�����_____��____��
��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C��I��II��III���η���__��__��
| a | b | c | d | |
| I | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
| II | ��ʯ�� | �轺 | Ũ���� | ��ˮ�Ȼ��� |
| III | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
�����װ��D��E��Ŀ���DZȽ��ȡ��塢��ķǽ����ԡ�����D�л���ͨ����������ʱ�����Կ�����ɫ��Һ��Ϊ__��__ɫ��˵���ȵķǽ����Դ����塣��������װ��D��������Һ����װ��E�У����۲쵽��������___________��____________��
��װ��F����������Na2SO3��Һ�������ȣ���д����Ӧ�����ӷ�Ӧ����ʽ��___��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���������ָ���������ܴ����������
A���������������� H+��Cu2+��Cl����NO3��
B��pH=1����Һ�У�Na+��CH3COO����Cl����Cu2+
C��ʹ��ɫʯ����Һ��������Һ�У�K+��Cl-��NO3����HCO3��
D����������Һ�У�Cu2+��K+��NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(NH4)2Cr2O7��һ�������ֽ���Σ��ڷֽ�Ĺ����з�����������ԭ��Ӧ�����и����(NH4)2Cr2O7���ȷֽ������жϣ�����ʵ�ʵ���
A��CrO3 �� NH3 �� H2O B��Cr2O3 ��NH3 �� H2O
C��CrO3 �� N2 �� H2O D��Cr2O3 ��N2�� H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijͬѧ����ˮ�ʼ��վ����480 mL 0.5 mol��L��1 NaOH��Һ�Ա�ʹ�á�
��1����ͬѧӦѡ��________ mL������ƿ��
��2���������������ͼ ��ʾ������ͼ����Ӧ����ͼ�е�__________(��ѡ����ĸ)֮�䡣
��ʾ������ͼ����Ӧ����ͼ�е�__________(��ѡ����ĸ)֮�䡣
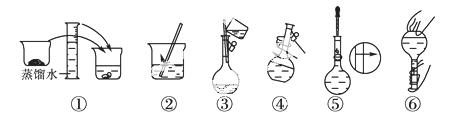
A������ۡ�������B������ڡ�������C�������
��3����ͬѧӦ��ȡNaOH����________g��������Ϊ23.1 g���ձ�����������ƽ�ϳ�ȡ����NaOH����ʱ�����ڸ�����ѡȡ����������С________(����ĸ)��������ͼ��ѡ������ȷ��ʾ����λ�õ�ѡ��________(����ĸ)��
������������
| a | b | c | d | e | |
| �����С/g | 100 | 50 | 20 | 10 | 5 |
��4�����в�����������Һ��Ũ�ȴ�С�к�Ӱ�죿
��ת������Һ��δϴ�Ӳ��������ձ���Ũ�Ȼ�________(�ƫ����ƫС������Ӱ�족����ͬ)��
������ƿ��ԭ������������ˮ��Ũ�Ȼ�________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ȣ�SO2Cl2����һ���л��Ȼ�����Ҳ��﮵�������������ʡ���֪��������һ����ɫҺ�壬�۵�-54.1�棬�е�69.1�棬��ˮ��������ˮ�⡣
��1����֪��SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g) ��H=a kJ��mol��1
2SOCl2 (g) ��H=a kJ��mol��1
SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) ��H=b kJ��mol��1
2SOCl2(g) ��H=b kJ��mol��1
��Ӧ��SO2(g) + Cl2 (g) SO2Cl2(g) ��H =������kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ�����÷�Ӧƽ�ⳣ������ʽΪK =��������
SO2Cl2(g) ��H =������kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ�����÷�Ӧƽ�ⳣ������ʽΪK =��������
��2�������ȿ����������ӦΪ��P4 + 10 SO2Cl2 = 4PCl5 + 10SO2����������1molSO2����ת�Ƶ��ӵ����ʵ���Ϊ������mol��
��3��ijѧϰС���ͬѧ���ݷ�Ӧ��SO2(g)+ Cl2(g) SO2Cl2(g) ��H ��0����Ƶ��Ʊ�������װ������20ͼ-1��
SO2Cl2(g) ��H ��0����Ƶ��Ʊ�������װ������20ͼ-1��

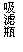

������Ũ�������������Ϊԭ����ȡCl2���䷴Ӧ�Ļ�ѧ����ʽΪ��������
���й���20ͼ-1��ʾ��װ��˵����ȷ������������������ѡ��
a.A��E��ϴ��ƿ��ʢ�ŵĿ��ֱܷ��DZ���ʳ��ˮ�ͱ���Na2SO3��Һ
b.B����Ӧ���������в������ϵĻ���̿������
c.B����Ӧ����ȴˮӦ��m�ӿ�ͨ��
d.װ��C������ƿӦ���ڱ�ˮ����ȴ
e.D��U�ι���ʢ�ŵĿ����Ǽ�ʯ��
�۴ӻ�ѧƽ���ƶ��Ƕȷ�������Ӧ��ͨˮ��ȴ��Ŀ��Ϊ��������
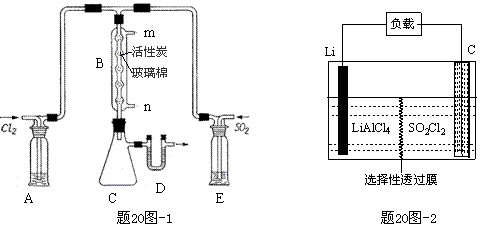
��4��GET��˾������Li-SO2Cl2���õ�أ���ʾ��ͼ����20ͼ-2��ʾ����֪��ط�ӦΪ��
2Li + SO2Cl2 = 2LiCl + SO2�������ع���ʱ�������ĵ缫��ӦʽΪ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com