
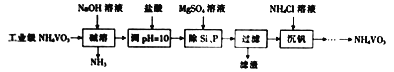
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
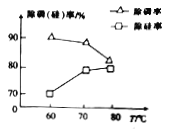
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
【答案】 ac 3×10-4mol·L-1 促进Mg2+水解生成Mg(OH)2 SiO32-+2H2O![]() H2SiO3↓+2OH-(或SiO32-+3H2O
H2SiO3↓+2OH-(或SiO32-+3H2O![]() H4SiO4↓+2OH-) 水浴加热 9 使两份溶液总体积相等,便于比较 2NH4VO3+4H2C2O4═(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O
H4SiO4↓+2OH-) 水浴加热 9 使两份溶液总体积相等,便于比较 2NH4VO3+4H2C2O4═(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O
【解析】以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程为:在偏钒酸铵中加氢氧化钠溶液,将偏钒酸铵溶解,铵盐遇到强碱生成氨气,再加盐酸调节溶液的pH值,加硫酸镁,生成Mg3(PO4)2、MgSiO3沉淀,过滤除去滤渣,在滤液中加氯化铵得偏钒酸铵。
(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,故选a,由于氨气在水中形成氨水能电离出氢氧根离子,根平衡移动原理,增加氢氧根浓度可以减小氨气 的溶解度,故选c,故答案为:ac;
(2)①根据Ksp[Mg3(PO4)2]=c3(Mg2+)c2(PO43-)可知,当c(PO43-)=10-6molL-1时,c(Mg2+)= =4×10-5molL-1,故答案为:4×10-5;
=4×10-5molL-1,故答案为:4×10-5;
②根据影响盐类水解的因素可知,升高温度水解程度增大,镁离子、硅酸根离子都是易水解的离子,所以升温促进Mg2+水解生成Mg(OH)2,使硅酸根水解生成硅沉淀,反应的离子方程式为SiO32-+2H2O![]() H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O![]() H4SiO4↓+2OH-),故答案为:SiO32-+2H2O
H4SiO4↓+2OH-),故答案为:SiO32-+2H2O![]() H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O![]() H4SiO4↓+2OH-);
H4SiO4↓+2OH-);
(3)反应温度需控制在50℃可以用水浴加热,故答案为:水浴加热;
(4)探究NH4Cl的浓度对沉钒率的影响,为要有可比性,两溶液的体积必须相等,所以要向A中加入约9mL蒸馏水,使两份溶液总体积相等,故答案为: 9;使两份溶液总体积相等,便于比较;
(5)偏钒酸本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2〔(VO)2(C2O4)3〕,反应的化学方程式为2NH4VO3+4H2C2O4═(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O,故答案为:2NH4VO3+4H2C2O4═(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的食盐都是“加碘食盐”.“加碘食盐”中加的是含碘元素的物质是碘酸钾(KIO3),KIO3属于( )
A.酸
B.碱
C.盐
D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质既可以与盐酸反应,又可以与NaOH溶液反应放出H2,且E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 __________________。
(2)B的最高价氧化物化学式为_____________,C的元素名称为 __________,D的单质与水反应的方程式为___________________。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是________________________,有关反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是
2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是

A. 若温度升高,混合气体的颜色变深
B. 在该温度下反应2NO2(g)![]() N2O4(g)的平衡常K为25/9
N2O4(g)的平衡常K为25/9
C. 反应达平衡后,将反应容器的容积减少一半,平衡向正反应方向移动
D. 反应达平衡后,向此容器中通入NO2气体,则c(NO2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是

A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7
B.25℃时,0.2mol/L Ba(OH)2 溶液和0.2 mol/L HC1溶液等体积混合,所得溶液的pH等于7
C.25℃时,0.2 mol/L NaOH溶液与 0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH大于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在,我们把无污染.无公害的食品叫做绿色食品。而最初,专家把绿色植物通过光合作用转化的食品叫做绿色食品,海洋提供的食品叫做蓝色食品,通过微生物发酵制得的食品叫做白色食品。根据最初的说法,下列属于绿色食品的是( )
A. 大米 B. 海带 C. 食醋 D. 食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
(1)混合溶液pH=8的原因是 (用离子方程式表示)
(2)混合溶液中由水电离出的c(OH-) (填“大于”、“等于”或“小于”)0.1mol/LNaOH溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)- c(A-)= mol/L, c(OH-)- c(HA)= mol/L
(4)常温下,将PH=2的酸HA溶液与PH=12的NaOH溶液等体积混合后,所得溶液PH 7 (填“大于”、“等于”或“小于”)
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH 7(填“大于”、“等于”或“小于”);将同温度下等浓度的下列四种盐溶液按PH由大到小的顺序排列是 (填序号)
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B. 25℃时,等体积等物质的量浓度的硝酸与氨水混合后,溶液pH=7
C. 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D. 25℃时,pH=2的酸HA溶液与pH=12的玻BOH溶液等体积混合后,所得溶液呈酸性,证明HA为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是 ( )
A.在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42-
B.在含有大量H+ 的 溶液中:Na+、K+、CO32-、NO3-
C.在强酸的溶液中:NH4+、Na+、SO42-、Cl-
D.在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com