
分析 (1)可以是胶体发生聚沉,氧化生成铁离子,进一步水解得到氢氧化铁胶体,吸附悬浮物质,最终生成氢氧化铁沉淀;
(2)水的硬度由碳酸氢钙和碳酸氢镁引起的,这种水的硬度叫暂时硬度;碳酸氢钙与足量的氢氧化钙反应生成碳酸钙与水,碳酸氢镁与足量的氢氧化钙反应生成碳酸钙、氢氧化镁与水;
(3)海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法;
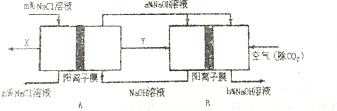
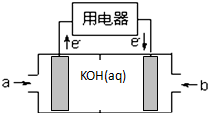
(4)B装置中通入空气和Y,空气作氧化剂,且整个装置是原电池和电解池组合的装置,B能自发的进行氧化还原反应,所以B是原电池,则A是电解池;
燃料电池中氢气是燃料,在负极上通入,空气是氧化剂,在正极上通入,负极上失电子发生氧化反应,正极上得电子发生还原反应,电解池中,电解氯化钠溶液时,阳极上氯离子放电生成X氯气,阴极上氢离子放电生成Y为氢气,同时得到氢氧化钠;
(5)①含氢质量分数最高的有机物为CH4,水和甲烷反应制取H2,还生成CO或二氧化碳;
②假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,根据原子守恒计算制备硝酸的氨气,每一步损失率、利用率都以氨气计算;
硝酸厂的选址应考虑运输、能源、污染问题、地价等方面因素.
解答 解:(1)硫酸亚铁属于电解质,可以是胶体发生聚沉,氧化生成铁离子,进一步水解得到氢氧化铁胶体,吸附细小的悬浮物质,最终生成氢氧化铁沉淀,
故答案为:细小的悬浮物质和胶体;Fe(OH)3;
(2)水的硬度由碳酸氢钙和碳酸氢镁引起的,这种水的硬度叫暂时硬度;碳酸氢钙与足量的氢氧化钙反应生成碳酸钙与水,离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,
碳酸氢镁与足量的氢氧化钙反应生成碳酸钙、氢氧化镁与水,离子方程式为:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O,
故答案为:暂时硬度;Ca2++HCO3-+OH-=CaCO3↓+H2O,Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O;
(3)海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法,
故答案为:蒸馏法、电渗析法、离子交换法;
(4)根据图片知,B装置中通入空气和Y,空气作氧化剂,且整个装置是原电池和电解池组合的装置,B能自发的进行氧化还原反应,所以B是原电池,则A是电解池;
A.通过以上分析知,A是电解池,B是原电池,原电池中燃料是氢气,所以Y是氢气,则X是氯气,故A错误;
B.A是电解池,电解氯化钠过程中,氯化钠溶液被电解时生成氯气、氢气和氢氧化钠,所以导致溶液中氯化钠浓度降低,所以m>n,故B错误;
C.B是燃料电池,正极上氧气得电子和水反应生成氢氧根离子,导致正极区域氢氧化钠浓度增大,所以a<b,故C错误;
D.B装置是把化学能转变为电能的装置,属于原电池,且正极上氧气得电子和水反应生成氢氧根离子,导致正极区域氢氧化钠浓度增大,故D正确;
故选:D;
(5)①含氢质量分数最高的有机物为CH4,水和甲烷反应制取H2,还生成CO或二氧化碳,反应方程式为:CH4+H2O$\frac{\underline{\;一定条件\;}}{\;}$3H2+CO等,
故答案为:CH4+H2O$\frac{\underline{\;一定条件\;}}{\;}$3H2+CO等;
②假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,制备的硝酸为1mol,令制备硝酸的氨气为xmol,每一步损失率、利用率都以氨气计算,根据原子守恒,xmol×96%×92%=1mol,解得x=$\frac{10000}{96×92}$,则与HNO3反应所用去NH3的质量占总耗NH3质量的$\frac{\frac{10000}{96×92}mol}{1mol+\frac{10000}{96×92}mol}$×100%≈47%,
硝酸厂的选址应具备以下有利条件:原料与产品运输方便,生成动力来源充足,废物易于处理,地价较便宜等,
故答案为:47%;原料与产品运输方便,生成动力来源充足,废物易于处理,地价较便宜等.
点评 本题考查化学与技术、原电池与电解原理、多步反应的有关计算,属于拼合型题目,(5)中注意利用守恒思想计算,也可以利用关系式计算,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
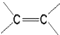 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 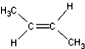 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AY溶液的pH小于7 | |
| B. | AY溶液的pH小于BY溶液的pH | |
| C. | 稀释相同倍数,BX溶液的pH变化小于BY溶液 | |
| D. | 电离平衡常数K(BOH)小于K(HY) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有部分短周期元素的性质或原子结构如表:
现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 原子序数最小的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3 |
| D | 单质的一种同素异形体是保护地球地表环境的重要屏障 |
| E | 最高正化合价为+7 |
| F | 第3周期元素原子半径 最大 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com