
| A. | 稀盐酸 | B. | 二氧化碳 | C. | 酒精 | D. | 硫酸钡 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L C2H6中含有共价键的数目为3.5NA | |
| B. | 通常状况下,2.0 g H2 和1 mol Cl2反应后的气体分子数目为2NA | |
| C. | 1molAl分别与足量的盐酸、足量的NaOH溶液反应,转移的电子数都是3NA | |
| D. | 将3.4g H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr | |
| B. | 常温下,浓度为0.1mol•L-1的HA溶液(Ka=10-5)pH≈3 | |
| C. | c(SO32-)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3) | |
| D. | 25℃时,向10mL0.01mol•L-1KOH溶液中滴加10mL0.01mol•L-1的醋酸溶液后,混合液中:c(K+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )| A. | 电极Ⅱ为阳极,发生还原反应 | |
| B. | 通电后H+通过阳离子交换膜向电极Ⅰ方向移动,电极Ⅱ区溶液pH增大 | |
| C. | 阴极区电极反应式为:2SO2+2e-═S2O42- | |
| D. | 若通电一段时间后溶液中H+转移0.1mol,则处理标准状况下SO2废气2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将△H<0的氧化还原反应设计成原电池,将化学能转变为电能 | |
| B. | 轮船水线以下的船壳上,嵌一定数量的锌块,保护船体不被腐蚀 | |
| C. | 在锌与稀硫酸反应的溶液中加入少量CuSO4,能加快生成H2的速率 | |
| D. | 为了保护地下钢管不受腐蚀,将它与一定电压的直流电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu、Ag、AgNO3溶液 | B. | Zn、Cu、稀硫酸 | ||
| C. | Fe、Zn、CuSO4溶液 | D. | Fe、C、Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由12C、16O、14N组成的44gCO2和44gN2O中含有的中子数均为22NA | |
| B. | 2L 0.5mol/L亚硫氢硫酸钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl时转移的电子数等于0.2NA | |
| D. | 适当条件下2molSO2与2molO2充分反应,反应体系中最终的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
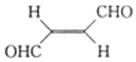
| A. | 分子中只有极性键 | B. | 分子中有σ键和π键 | ||
| C. | 该分子中三种元素的电负性:H>C>0 | D. | 该分子在水中的溶解度小于甲烷的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com