
| A. | 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | KHS溶液中HS-的电离:HS-+H2O?H3O++S2- |
分析 A.生成的是氢氧化铁胶体,不能使用沉淀符号;
B.硫化亚铁为难溶物,离子方程式中不能拆开;
C.镁离子与氢氧根离子结合生成氢氧化镁沉淀;
D.HS-在溶液中电离出硫离子和氢离子,存在电离平衡.
解答 解:A.将饱和FeCl3溶液滴入沸水中制备胶体,不能用沉淀符号,正确的离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故A错误;
B.用FeS去除废水中的Hg2+,硫化亚铁不能拆开,正确的离子方程式为:Hg2++FeS═HgS+Fe2+,故B错误;
C.用惰性电极电解MgCl2溶液,反应生成氢氧化镁沉淀、氯气和氢气,正确的离子反应为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Mg(OH)2↓+Cl2↑+H2↑,故C错误;
D.KHS溶液中HS-的电离方程式为:HS-+H2O?H3O++S2-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式、电离方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式等,C为易错点,注意氢氧根离子与镁离子反应生成氢氧化镁沉淀.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 在pH=0的溶液中:Na+、NO3-、SO32-、K+ | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两容器中所含气体分子数一定不同 | |
| B. | 两容器中所含气体的质量一定不同 | |
| C. | Y容器中CH4、O2、N2的质量之比可以为1:6:3 | |
| D. | Y容器中CH4、O2、N2的物质的质量之比一定为1:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、I- | |
| B. | 水电离的H+浓度为1×10-13mol•L-1的溶液中,K+、Al3+、Cl-、SO42- | |
| C. | AlO2?浓度为0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
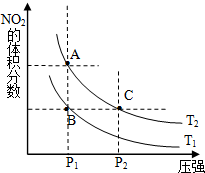 (1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).
(1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:K+、Cu2+、Br-、SO42- | |
| B. | 含有0.1 mol•L-1I-的溶液:NH4+、Fe3+、SO42-、Cl- | |
| C. | 含有0.1 mol•L-1HCO3-的溶液:Na+、Al3+、NO3-、OH- | |
| D. | 强酸性溶液:K+、Mg2+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2完全燃烧生成气态水放出285.8kJ热量,则H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后最高温度 | |
| C. | 在101 kPa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题:
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题: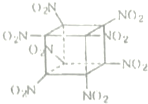 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com