

| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | a=0.05 | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol |
分析 A.酸或碱抑制水电离,含有弱离子的盐促进水电离,碱中c(OH-)越大其抑制水电离程度越大,含有弱离子的盐浓度越大,水的电离程度越大;
B.如果a=0.05,NH4Cl和NaOH反应后溶液中溶质为等物质的量的NH3.H2O和NH4Cl、NaCl,NH3.H2O的电离程度大于NH4Cl水解程度,导致溶液中c(NH4+)>c(NH3.H2O);
C.当n(NaOH)=0.05mol时,NH4Cl和NaOH反应后溶液中溶质为等物质的量的NH3.H2O和NH4Cl、NaCl,NH3.H2O的电离程度大于NH4Cl水解程度,导致溶液呈碱性;
D.M点存在的物料守恒为c(Cl-)=c(NH4+)+c(NH4+)=0.1mol/L,电荷守恒为c(Na+)+c(NH4+)+c(H+)=c(Cl-)+c(OH-),根据电荷守恒、物料守恒判断.
解答 解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,碱中c(OH-)越大其抑制水电离程度越大,含有弱离子的盐浓度越大,水的电离程度越大,原溶液中溶质为氯化铵,M点溶液中溶质为氯化铵、一水合氨和NaCl,且M点氯化铵浓度小于原溶液,所以水电离程度:M点小于原溶液,故A错误;
B.如果a=0.05,NH4Cl和NaOH反应后溶液中溶质为等物质的量的NH3.H2O和NH4Cl、NaCl,NH3.H2O的电离程度大于NH4Cl水解程度,导致溶液中c(NH4+)>c(NH3.H2O),要使混合溶液中c(NH4+)=c(NH3.H2O),则混合溶液中c(NH3.H2O)<c(NH4Cl),则a<0.05,故B错误;
C.当n(NaOH)=0.05mol时,NH4Cl和NaOH反应后溶液中溶质为等物质的量的NH3.H2O和NH4Cl、NaCl,NH3.H2O的电离程度大于NH4Cl水解程度,导致溶液呈碱性,钠离子、氯离子不水解,所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故C错误;
D.M点存在的物料守恒为c(Cl-)=c(NH4+)+c(NH4+)=0.1mol/L,电荷守恒为c(Na+)+c(NH4+)+c(H+)=c(Cl-)+c(OH-),根据电荷守恒、物料守恒得c(OH-)-c(H+)=c(Na+)+c(NH4+)-c(Cl-)=(a+0.05-0.1)mol/L=(a-0.05)mol/L,n(OH-)-n(H+)=(a-0.05)mol/L×1L=(a-0.05)mol,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确M点溶液中溶质成分及其性质、各溶质物质的量相对大小是解本题关键,侧重考查学生分析、判断及计算能力,注意a不等于0.05,题目难度不大.


科目:高中化学 来源: 题型:选择题
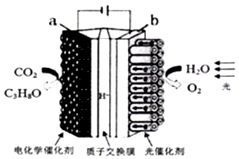 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O | |
| C. | 该装置工作时,H+从b极区向a极区迁移 | |
| D. | 每生成1molO2有44gCO2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硫酸干燥NH3 | B. | 用乙醇萃取溴水中的溴单质 | ||
| C. | 用品红溶液鉴别SO2和CO2 | D. | 用焰色反应鉴别KCl和KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
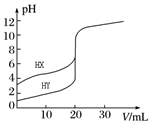 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )| A. | pH=7时,滴定HX消耗NaOH溶液体积等于20.00 mL | |
| B. | 将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH (HX) | |
| C. | 当NaOH溶液体积为20.00 mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30gC2H6中含有极性共价键的数目为6NA | |
| B. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| C. | 1mol氯气分别与铁和铝完全反应时转移的电子数均为3NA | |
| D. | 25℃,pH=7的NH4Cl和NH3•H2O的混合溶液中,含OH-的数目为10-7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸与碳酸钙 | B. | 稀硫酸与碳酸氢钠 | ||
| C. | 稀醋酸与碳酸钠 | D. | 稀硝酸与碳酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com