
0.05 mol/L H2SO4溶液滴定未知浓度的NaOH溶液,得到的滴定曲线如图所示.
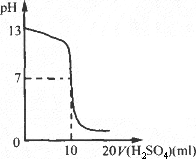
(1)用甲基橙做指示剂,滴定终点时颜色变化是________.
(2)未知浓度NaOH溶液的物质的量浓度是________.
(3)未知浓度NaOH溶液的体积是________.
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:广东省汕头市金山中学2011-2012学年高二上学期12月月考化学试题 题型:013
|
常温下,0.1 mol/L某一元酸(HA)溶液中 | |
| [ ] | |
A. |
溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
B. |
溶液中c(H+)+c(A-)=0.1 mol/L |
C. |
溶液中水电离出的c(H+)=10-10 mol/L |
D. |
与0.05 mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第9期 总第165期 人教课标版(选修4) 题型:022
(1)25℃时,0.05 mol/L H2SO4溶液的pH=________;0.05 mol/L Ba(OH)2溶液中c(H+)=________.
(2)某温度下纯水中的c(H+)=2.0×10-7 mol/L,则此时溶液中的c(OH-)=________;若温度不变,滴入稀盐酸,使c(H+)=5.0×10-4 mol/L,则溶液中c(OH-)=________,此时溶液中由水电离产生的c(H+)=________.
查看答案和解析>>
科目:高中化学 来源:浙江省宁波市2011届高三上学期期末试题化学试题 题型:013
|
下列溶液中微粒的物质的量浓度关系一定正确的是 | |
| [ ] | |
A. |
0.1 mol/L NH4Cl溶液与0.05 mol/L NaOH溶液等体积混合后所得的碱性溶液中:c(Cl-)>c(Na+)>c(NH |
B. |
等物质的量的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=c(HCO |
C. |
pH=2的HA溶液与pH=12的MOH溶液等体积混合: c(M+)=c(A-)>c(OH-)=c(H+) |
D. |
某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源:山西省大同一中2008-2009学年上学期高三期中试卷(化学) 题型:038
2008年我国南方地区遭受了历史上罕见的特大的冰雪,交通堵塞,电网中断,给群众的生活带来很多困难.化学试剂氯化钙作为融雪剂在抗雪灾中起了一定的作用.氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等.为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35.00 mL 0.25 mol/L(NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全.②过滤并洗涤①所得沉淀.③加入足量的10%H2SO4和适量的蒸馏水,④中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16.00 mL,恰好完全反应.
回答下列问题:
(1)配平:________MnO4-+________H2C2O4+________H+―________Mn2++________CO2↑+________H2O
(2)0.05 mol·L-1KMnO4标准溶液应置于________(选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为________.
(3)计算该氯化钙样品中钙元素的质量分数为________(精确到0.01%).
查看答案和解析>>
科目:高中化学 来源:江苏省高淳高级中学2008届高三质量检测化学试卷 题型:058
氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等.为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35 mL 0.25 mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全.
②过滤并洗涤①所得沉淀.
③加入足量的10%H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16 mL,恰好完全反应.
回答下列问题:
(1)配平:________MnO4-+________H2C2O4+________H+―________Mn2++________CO2↑+________H2O
(2)0.05 mol·L-1 KMnO4标准溶液应置于________(选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为________________.
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com