
在反应Fe2O3+3CO====2Fe+3CO2中,____________元素的化合价升高,该元素____________电子被____________,____________是还原剂, ____________表现还原性, ____________发生了氧化反应,氧化产物是____________;____________元素的化合价降低,该元素的原子____________电子,被____________,____________是氧化剂,表现了氧化性, ____________发生了还原反应,还原产物是____________。
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:阅读理解

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| 检验成分 | 操作步骤 | 实验现象与结论 |
| 铝 | 取少量固体样品加入NaOH溶液中 取少量固体样品加入NaOH溶液中 |
若有(无)气泡产生,说明该样品中含有(不含)铝 若有(无)气泡产生,说明该样品中含有(不含)铝 |
| 氧化铁 | 取少量样品加入稀硫酸中,滴加KSCN溶液 取少量样品加入稀硫酸中,滴加KSCN溶液 |
若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3 若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
查看答案和解析>>
科目:高中化学 来源: 题型:
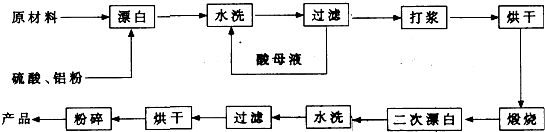
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com