

| ||
| △ |
| ||
| △ |
| 1mol×26g/mol |
| 2g |
| 5 |
| 2 |
| 5 |
| 2 |
 ;
; ;OH-+CO2═HCO3-.
;OH-+CO2═HCO3-.


科目:高中化学 来源: 题型:
A、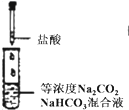 逐滴滴加稀盐酸时,试管中立即产生大量气泡 |
B、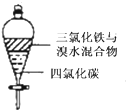 充分振荡后静置,下层溶液为橙红色,上层无色 |
C、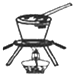 从饱和食盐水中提取NaCl晶体 |
D、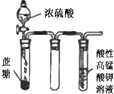 酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
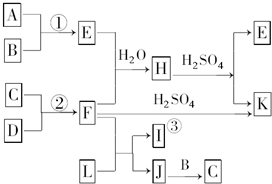
查看答案和解析>>
科目:高中化学 来源: 题型:
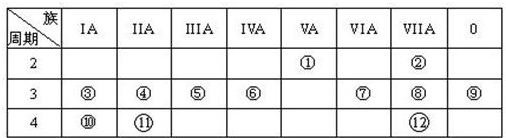
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | G | H | I | |||||
| 3 | B | Mg | C | D | E | F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com