
 ,由C生成D的化学方程式为
,由C生成D的化学方程式为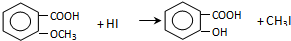 .
.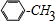 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$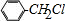 +HCl.反应类型为取代反应
+HCl.反应类型为取代反应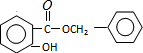 .
. (或
(或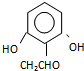 ).
). ,反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
,反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为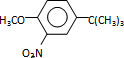 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.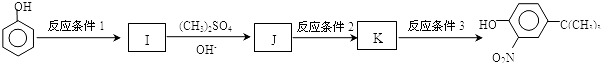
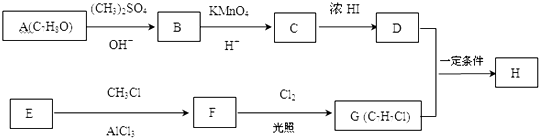
分析 核磁共振氢谱显示A苯环上有四种化学环境的氢,它们的位置相邻,结合A的分子式及信息反应①可知A为邻甲基苯酚: ;A发生信息反应①生成B,则B为
;A发生信息反应①生成B,则B为 ;B中侧链的甲基被酸性高锰酸钾溶液氧化成羧基,则C为
;B中侧链的甲基被酸性高锰酸钾溶液氧化成羧基,则C为 ;C按照信息反应①生成D,在D溶液中滴加几滴FeCl3溶液,溶液呈紫色,说明D中含有酚羟基,则D为:
;C按照信息反应①生成D,在D溶液中滴加几滴FeCl3溶液,溶液呈紫色,说明D中含有酚羟基,则D为: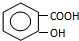 ;
;
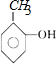
芳烃F的相对分子质量介于90~100之间,0.1molF充分燃烧可生成7.2g水,1molF中含有氢原子的数目为:$\frac{\frac{7.2g}{18g/mol}×2}{0.1mol}$=8,结合F与氯气发生在取代反应生成的G的分子式可知,F的分子式为:C7H8,则F为甲苯: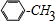 ,故G为:
,故G为: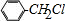 ;E与一氯甲烷在氯化铝存在条件下反应生成F,则E为
;E与一氯甲烷在氯化铝存在条件下反应生成F,则E为 ;D和G按照信息⑤反应生成H,则H为:
;D和G按照信息⑤反应生成H,则H为: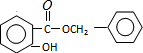 ,据此进行解答.
,据此进行解答.
解答 解:核磁共振氢谱显示A苯环上有四种化学环境的氢,它们的位置相邻,结合A的分子式及信息反应①可知A为邻甲基苯酚: ;A发生信息反应①生成B,则B为
;A发生信息反应①生成B,则B为 ;B中侧链的甲基被酸性高锰酸钾溶液氧化成羧基,则C为
;B中侧链的甲基被酸性高锰酸钾溶液氧化成羧基,则C为 ;C按照信息反应①生成D,在D溶液中滴加几滴FeCl3溶液,溶液呈紫色,说明D中含有酚羟基,则D为:
;C按照信息反应①生成D,在D溶液中滴加几滴FeCl3溶液,溶液呈紫色,说明D中含有酚羟基,则D为: ;
;
芳烃F的相对分子质量介于90~100之间,0.1molF充分燃烧可生成7.2g水,1molF中含有氢原子的数目为:$\frac{\frac{7.2g}{18g/mol}×2}{0.1mol}$=8,结合F与氯气发生在取代反应生成的G的分子式可知,F的分子式为:C7H8,则F为甲苯: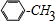 ,故G为:
,故G为: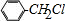 ;E与一氯甲烷在氯化铝存在条件下反应生成F,则E为
;E与一氯甲烷在氯化铝存在条件下反应生成F,则E为 ;D和G按照信息⑤反应生成H,则H为:
;D和G按照信息⑤反应生成H,则H为: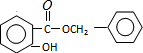 ,
,
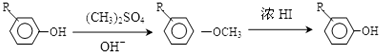
(1)A的结构简式为 ,其名称为2-甲基苯酚;由C生成D的化学方程式为:
,其名称为2-甲基苯酚;由C生成D的化学方程式为:
故答案为:2-甲基苯酚; ;
;
(2)F为甲苯: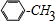 ,甲苯在光照条件下与氯气发生取代反应生成
,甲苯在光照条件下与氯气发生取代反应生成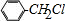 ,反应的化学方程式为:
,反应的化学方程式为: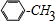 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$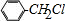 +HCl,
+HCl,
故答案为: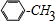 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$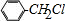 +HCl;取代反应;
+HCl;取代反应;
(3)根据分析可知,H的结构简式为: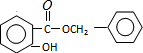 ,
,
故答案为: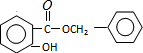 ;
;
(4)C为 ,C的同分异构体中①苯环含有三个取代基;②有两个和A完全一样的官能团,说明含有酚羟基;③可发生银镜反应说明含有醛基,
,C的同分异构体中①苯环含有三个取代基;②有两个和A完全一样的官能团,说明含有酚羟基;③可发生银镜反应说明含有醛基,
所以满足条件的C的同分异构体中含有2个酚羟基、1个-CH2CHO,
当3个取代基都相邻时,中间为羟基或醛基,有2种结构;
当两个羟基相邻时,存在1种结构;
当1个羟基与-CH2CHO相邻时,另一个羟基可以在间位,有2种结构;
3个取代基都不相邻时有1种结构,所以总共存在6种同分异构体;
其中核磁共振氢谱为5组峰,且面积比为1:2:2:2:1,该有机物分子中含有5种H原子,且具有一定的对称结构,满足条件的有机物的结构简式为: 或
或 ,
,
故答案为:6; (或
(或 );
);
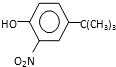
(5)由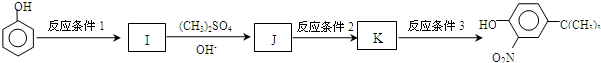 ,根据初始原料苯酚、最终产物
,根据初始原料苯酚、最终产物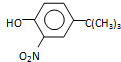 可知,反应过程中需要引进硝基、-C(CH3)3,结合信息反应可知,I转化成J是为了保护酚羟基,反应1中一定引进了-C(CH3)3,所以反应条件1为(CH3)3CCl/AlCl3,I为
可知,反应过程中需要引进硝基、-C(CH3)3,结合信息反应可知,I转化成J是为了保护酚羟基,反应1中一定引进了-C(CH3)3,所以反应条件1为(CH3)3CCl/AlCl3,I为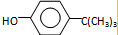 ;再利用逆推法,反应条件3应该为将酚羟基还原,则K为
;再利用逆推法,反应条件3应该为将酚羟基还原,则K为 ,反应条件3为浓HI;反应2通过硝化反应引进硝基,
,反应条件3为浓HI;反应2通过硝化反应引进硝基,
故答案为:(CH3)3CCl/AlCl3; ;浓HI.
;浓HI.
点评 本题考查了有机合成,为高频考点,根据合成流程明确合成原理为解答关键,注意熟练掌握常见有机物结构与性质及同分异构体的概念及书写原则,(5)为难点,需要充分利用题中信息反应原理,试题充分考查了学生的分析、理解能力及逻辑推理能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法不正确的是( )
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法不正确的是( )| A. | a点对应的Ksp等于c点对应的Ksp | B. | 加入Na2SO4溶液可以使a点变为b点 | ||
| C. | a点变为b点将有沉淀生成 | D. | d点未达到沉淀溶解平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加入NaHCO3使氯水的漂白能力增强 | |
| C. | 难溶电解质可以由溶解度小的转化为溶解度更小的,但不能从溶解度小的转化为溶解度大的 | |
| D. | Ksp只受温度的影响,不受浓度的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O,酯化反应或取代反应.
CH3COOCH2CH3+H2O,酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10O的同分异构体有很多种,其中属于醇类的只有4种 | |
| B. | 水解得到的两种物质,C2H4O2可以与金属钠作用产生氢气,而C4H10O不可以 | |
| C. | 水解得到的物质C2H4O2和葡萄糖的最简式相同,所以二者的化学性质相似 | |
| D. | 该同学分离出的酯的化学式可表示为C6H12O2,它的同分异构体属于酯类的有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅单质可用来制造太阳能电池 | |
| C. | SiO2是制造光导纤维的材料 | |
| D. | 可用带玻璃塞的试剂瓶中盛有NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com