

分析 由流程可知,铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入稀盐酸,得到滤渣为二氧化硅,滤液A中含有铁离子、亚铁离子和铝离子;加入漂白液后亚铁离子氧化成铁离子,铁离子水解生成氢氧化铁沉淀;滤液B为氯化铝溶液;二氧化硫与氢氧化钠在铁坩埚中焙烧生成硅酸钠,
(1)①发生氧化还原反应,红褐色沉淀为氢氧化铁;
②滤液B中铝元素为氯化铝,氢氧化铝溶液能溶于强酸强碱,不溶于弱碱;
(2)①得到含结晶水的晶体,蒸发浓缩、冷却结晶、过滤、洗涤;
②得到无水氯化铝,溶于浓硫酸进行蒸馏,浓硫酸吸收水、难挥发,与脱水性、强氧化性无关;
(3)A.蒸发皿中含有二氧化硅和氢氧化钠反应;
B.铁坩埚可以熔融二氧化硅和氢氧化钠;
C.玻璃中含二氧化硅和氢氧化钠反应;
D.玻璃中含二氧化硅和氢氧化钠反应.
解答 解:由流程可知,铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入稀盐酸,得到滤渣为二氧化硅,滤液A中含有铁离子、亚铁离子和铝离子;加入漂白液后亚铁离子氧化成铁离子,铁离子水解生成氢氧化铁沉淀;滤液B为氯化铝溶液;二氧化硫与氢氧化钠在铁坩埚中焙烧生成硅酸钠,
(1)①滤液A中加入漂白液,发生氧化还原反应生成红褐色沉淀,用离子方程式表示为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,
故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+;
②A.氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,氢氧化钠不是最佳试剂,故A错误;
B.硫酸溶液不与铝离子反应,故B错误;
C.一水合氨是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故C正确;
D.二氧化碳和氯化铝不反应,无法生成氢氧化铝沉淀,故D错误;
故答案为:C;
(2)①得到含结晶水的晶体,涉及的操作为蒸发浓缩、冷却结晶、过滤、洗涤,故答案为:蒸发浓缩;过滤;
②AlCl3能水解,直接加热AlCl3•6H2O,水解彻底生成氢氧化铝,得不到氯化铝,浓硫酸具有吸水性,能吸收AlCl3•6H2O中的水,且浓硫酸不挥发,能抑制氯化铝水解,利用浓硫酸的吸水性与难挥发性,
故选:②③;
(3)A.蒸发皿中含有二氧化硅和氢氧化钠反应,故A不符合;
B.铁坩埚可以熔融二氧化硅和氢氧化钠,故B符合;
C.玻璃中含二氧化硅和氢氧化钠反应,故C不符合;
D.瓷坩埚含有二氧化硅和氢氧化钠反应,且烧杯不能用于固体高温加热,故D不符合;
故答案为:B.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识及实验基本操作的综合运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
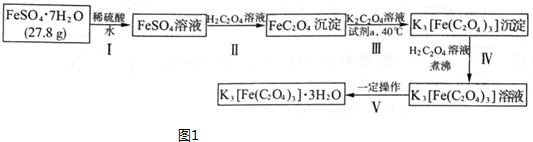
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

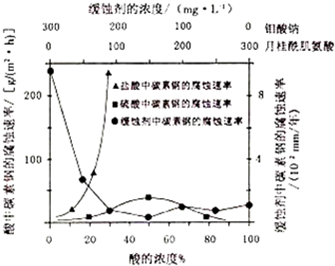
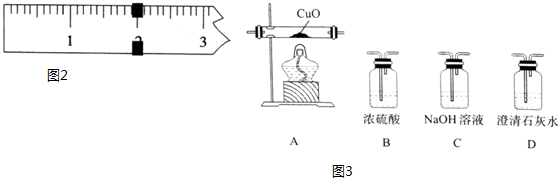
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
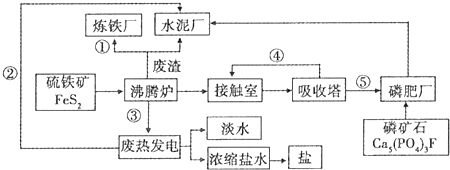
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com