
【题目】(1)氯化铁水解的离子方程式为_________________________________,实验室配制氯化铁溶液时,常将氯化铁先溶于浓盐酸,然后再加水稀释,其目的是_________________________。
(2)若向氯化铁溶液中加入碳酸钙粉末,碳酸钙逐渐逐渐溶解,并产生无色气体的离子方程式为________,溶液中同时有红褐色沉淀生成,其原因是______________。
【答案】Fe3+ + 3H2O![]() Fe(OH)3 + 3H+ 抑制Fe3+的水解,以得到较为纯净的FeCl3溶液 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ CaCO3与H+反应,溶液中H+浓度降低,促使Fe3+的水解平衡向正方向移动,从而产生Fe(OH)3沉淀
Fe(OH)3 + 3H+ 抑制Fe3+的水解,以得到较为纯净的FeCl3溶液 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ CaCO3与H+反应,溶液中H+浓度降低,促使Fe3+的水解平衡向正方向移动,从而产生Fe(OH)3沉淀
【解析】
(1)FeCl3属于强酸弱碱盐,铁离子水解生成氢氧化铁和氢离子导致其溶液呈酸性,根据同离子效应对水解程度的影响作答;
(2)FeCl3水解生成的HCl能和碳酸钙反应生成氯化钙、二氧化碳和水。
(1)FeCl3属于强酸弱碱盐,铁离子在水溶液中发生部分水解,其离子方程式为Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,加入酸后,溶液中氢离子浓度增大能抑制其水解,故答案为:Fe3+ + 3H2O
Fe(OH)3 + 3H+,加入酸后,溶液中氢离子浓度增大能抑制其水解,故答案为:Fe3+ + 3H2O![]() Fe(OH)3 + 3H+;
Fe(OH)3 + 3H+;
(2)水解生成的氯化氢能和碳酸钙反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3 + 2H+ = Ca2+ + H2O + CO2↑;消耗氢离子,氢离子浓度降低从而促进氯化铁水解,最终生成氢氧化铁红褐色沉淀,故答案为:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ CaCO3与H+反应,溶液中H+浓度降低,促使Fe3+的水解平衡向正方向移动,从而产生Fe(OH)3沉淀。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】R、W、X、Y、M是原子序数依次增大的五种主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是__________________________。
(2)WX2的电子式是_______________________。
(3)R2X、R2Y中,稳定性较高的是____(填化学式),请从原子结构的角度解释其原因:_____。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是________(填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_____________。
(5)科研人员从矿石中分离出一种氧化物,化学式可表示为M2O3。为确定M元素的种类,进行了一系列实验,结果如下:
①M的相对原子质量介于K和Rb(铷)之间;
②0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物,反应完全时,被M2O3氧化的Zn为0.06 mol;
综合以上信息推断,M可能位于元素周期表第_________________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电化学的下列说法正确的是
A.工业上用电解MgCl2溶液的方法冶炼Mg
B.钢铁发生吸氧腐蚀的正极反应式为4OH﹣-4e﹣═O2↑+2H2O
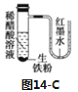
C.如图14-C中发生反应的方程式为:Fe+2H+=Fe2++H2↑
D.碱性锌锰干电池放电时的正极反应为: MnO2+H2O+e-=MnOOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸的电离:H2CO3![]() H+ +HCO3-
H+ +HCO3-
B. 将金属钠放入水中:Na+2H2O = Na+ +2OH-+H2↑
C. 碳酸钠水解:CO32-+2H2O = H2CO3+2OH-
D. 向氯化铝溶液中加入过量的烧碱溶液:Al3+ +3OH-= Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
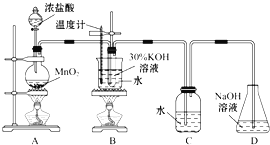
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
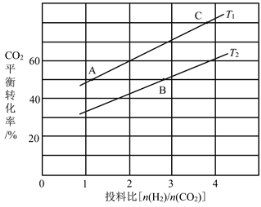
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%

在上述条件下合成甲醇的工业条件是____。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 乙烯与苯都能使溴水褪色,但褪色原理不同
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气 5mol
C. 溴水遇到乙醛溶液出现褪色现象,是因为发生了氧化反应
D. ![]() 与
与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 11月,国际计量大会第 26 次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,单位为 mol-1。基于这一新定义,阿伏加德罗常数的不确定度被消除了。下列说法正确的是
A.10g的1H218O含有的质子数与中子数均为5×6.02214076×1023
B.100gNaHSO4和20g KHSO3的固体混合物中阳离子数为2×6.02214076×1023
C.标准状况下,2.24L Cl2溶于水,转移电子数目为6.02214076×1022
D.12g金刚石中含有化学键的数目为4×6.02214076×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年中国十大科技成果之一是:我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如图(部分反应条件已略去):
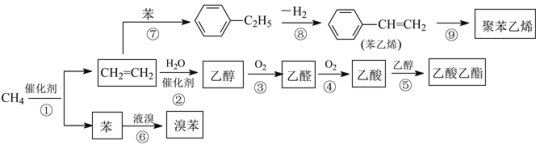
(1)乙酸分子中所含官能团名称为_____。
(2)聚苯乙烯的结构简式为_____。
(3)图中9步反应中只有两步属于取代反应,它们是_____(填序号)。
(4)写出下列反应的化学方程式(注明反应条件):
反应⑤为_____;
反应⑥为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com