
���� ��1���ټ���ȼ������Һ��ˮ���ȴ��ڼ��鷴Ӧ��������ˮ���ʱ�������űȽϣ�
��������������Ӧ��ͬ����������ͬ��Ӧ�Ȳ�ͬ��
�ۺ��������з�Ӧ���й�����ѹǿ��С����ѹ�����з�Ӧ������ѹǿ�Ⱥ��������з�Ӧ��ת���ʴ�
��̼��Ʒֽ����ȣ������ƺ�ˮ��Ӧ���ȣ��ʱ�������űȽϣ�
��2��װ��ͼ��ͭпԭ��أ�ͭ��������п����������Һ��ͭ��������������
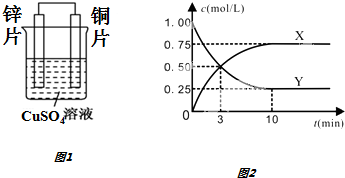
��3������ͼ��֪��Ӧ���е�3minʱ�����ĵ�Y�����ɵ�X��Ϊ0.5mol��˵�����ߵļ�������ͬ�����ݷ���ʽ�жϣ�
�ڷ�Ӧ���е�3minʱ����Ӧδ����ƽ��״̬�����ݶ�����̼��Ũ�ȱ仯���������Ũ�ȱ仯������Ӧ���ʣ�
����һ�������£�����ѧ��Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ������Ҳ���䣻
�����淴Ӧ��ƽ�ⳣ����Ϊ������ϵ��
���ȼ����ƽ�ⳣ��K���ٸ���Qc��K�Ĵ�С��ϵ�жϣ�
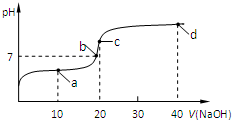
��4���٣�a����ҺΪCH3COOH��CH3COONa�Ļ�����Һ�����ԣ����������ڴ�������ӵ�ˮ�⣻
�ڣ����ݵ���غ�����жϣ���Һ���������ӵ��������ͬ��
�ۣ�c��ʱ����Һ�ʼ��ԣ���Һ�д��������غ㣻
�ܣ�d��ΪNaOH��CH3COONa�Ļ�����Һ�ʼ��ԣ�
��� �⣺��1������̬ˮ�仯ΪҺ̬ˮ���̷��ȣ�����ȼ������Һ��ˮ���ȴ��ڼ��鷴Ӧ��������ˮ���ʱ�������űȽϣ���H1����H2
��������������Ӧ��ͬ����������ͬ��Ӧ�Ȳ�ͬ��1mol����ȼ������Һ̬ˮ�ų�����С��2mol����ȼ������Һ̬ˮ�ų��������ʱ�������űȽϣ���H1����H2
�۶��������������Ӧ������������ķ�Ӧ�����������С�ķ��ȷ�Ӧ�����������з�Ӧ���й�����ѹǿ��С����ѹ�����з�Ӧ������ѹǿ�Ⱥ��������еķ�Ӧ��ת���ʴ�Q1��Q2��
��̼��Ʒֽ����ȣ������ƺ�ˮ��Ӧ���ȣ��ʱ�������űȽϣ���H1����H2
�����������٢۷��ϣ�
�ʴ�Ϊ���٢ۣ�
��2��������ԭ��ӦZn��s��+Cu2+��aq���TZn2+��aq��+Cu��s����Ƶ�ԭ��أ�ͭ��������п����������Һ��ͭ��������������
��ͭ�缫��ԭ��������������ĵ缫��ӦΪCu2++2e-�TCu���ʴ�Ϊ��Cu2++2e-�TCu��
��ԭ��ط�Ӧ�����е������Һ�������������������������������ʴ�Ϊ������
��3������ͼ��֪��Ӧ���е�3minʱ�����ĵ�Y�����ɵ�X��Ϊ0.5mol��˵�����ߵļ�������ͬ����֪CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
��Ӧ��YΪCO2���ʴ�Ϊ��CO2��
�ڷ�Ӧ���е�3minʱ����Ӧδ����ƽ��״̬����Ӧ��������У�����v����v������Ӧǰ3min�����ĵĶ�����̼Ϊ1.00-0.50=0.50mol/L�������ĵ�����Ϊ
0.50mol/L��3=1.50mol/L����v��H2��=$\frac{1.50mol}{3min}$=0.5mol•L-1•min-1��
�ʴ�Ϊ������0.5��
����һ�������£�����ѧ��Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬
A�������ڸ����������ȱ��ֲ��䣬˵�������ʵ������ֲ��䣬����֤���Ѿ��ﵽƽ��״̬����A��ȷ��
B����������������䣬�����غ㣬���Ի��������ܶ�ʼ�ղ��䣬���Բ���֤���Ѿ��ﵽƽ��״̬����B����
C���ﵽƽ��״̬ʱ����ͬ���ʵķ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����ƽ��״̬������3v����CH3OH��=v����H2�� ʱ��˵���Ѿ��ﵽƽ��״̬����C��ȷ��
D����ͼ��֪���ﵽƽ��״̬ʱ������̼ת����0.75mol/L����H2ת����0.75mol/L��3=2.25mol/L������������ת����Ϊ $\frac{2.25}{3}$��100%=75%����D��ȷ��
�ʴ�Ϊ��ACD��
�ܷ�ӦCH3OH��g��+H2O��g��?CO2��g��+3H2��g���Ƿ�ӦCO2��g��+3H2��g��?CH3OH��g��+H2O��g�����淴Ӧ�����ߵ�ƽ�ⳣ����Ϊ�����Ĺ�ϵ����K��=$\frac{1}{K}$=$\frac{1}{5.33}$=0.9���ʴ�Ϊ��0.19��
����ͼ��֪���ﵽƽ��״̬ʱ������̼ת����0.75mol/L����H2ת����0.75mol/L��3=2.25mol/L�����ɵ�c��CH3OH��=c��H2O��=0.75mol/L��
��ƽ��ʱc��CO2��=0.25mol/L��c��H2��=0.75mol/L��c��CH3OH��=0.75mol/L��c��H2O��=0.75mol/L��
��K=$\frac{c��C{H}_{3}COOH��c��{H}_{2}O��}{c��C{O}_{2}��{c}^{3}��{H}_{2}��}$=$\frac{0.75��0.75}{0.25��0.7{5}^{3}}$=5.33����������ͬʱ����1molCO2��1mol H2O��g������Qc=$\frac{0.75����1+0.75��}{��0.25+1����0.7{5}^{3}}$=2.49��K=5.33����Ӧδ����ƽ��״̬�����Է�Ӧ���ҽ��У�
�ʴ�Ϊ�����ң�
��4���٣�a��ʱ�����������ҺΪCH3COOH��CH3COONa�Ļ�����Һ�����ԣ�Ӧ����c��CH3COO-����c��CH3COOH�����ʢٴ���
�ڣ�������Һ����غ��֪��Һ��Ӧ����c��Na+��+c��H+��=c��CH3COO-��+c��OH-������Һ�����ԣ�Ӧ��c��H+��=c��OH-������c��Na+��=c��CH3COO-�����ʢ���ȷ��
�ۣ�c��ʱ����Һ�ʼ��ԣ�Ӧ��c��H+����c��OH-������Һ�д��������غ㣬c��OH-��=c��CH3COOH��+c��H+�����ʢ���ȷ��
�ܣ�d��ΪNaOH��CH3COONa�Ļ�����Һ�ʼ��ԣ�����CH3COO-��������ˮ�⣬����c��Na+����c��OH-����c��CH3COO-����c��H+�����ʢܴ���
��ѡ�ڢۣ�
���� ���⿼��ԭ���ԭ������ѧ��Ӧ�����仯����Ӧ���ʺ�ƽ�ⳣ���ļ��㡢��ѧƽ��ļ�����Ӱ�����ء��������Һ������Ũ�ȴ�С�͵���غ������غ�ķ����ȣ���Ŀ�漰��֪ʶ��϶࣬�Ѷ��еȣ������ڿ���ѧ�������ͽ�������������


 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Li Na K | B�� | Ba2+ Ca2+ Mg2+ | C�� | Ca2+ K+ Cl- | D�� | N O F |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| a | |||
| b | c | d |
| A�� | ���Ӱ뾶��b��c��d��a | |
| B�� | bn+��dm-��ˮ��Һ�п��γɻ�����bmdn | |
| C�� | ���⻯����ȶ��ԣ�a��c | |
| D�� | b��d������������Ӧ��ˮ��������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�5.6LCO2������Na2O2��Ӧת�Ƶĵ�����Ϊ0.5NA | |
| B�� | 23g Na������H2O��Ӧ��ȫ�������0.5NA��H2���� | |
| C�� | 2 L0.5mol•L-1�������Һ�����������������ΪNA | |
| D�� | ��״���£�11.2L���к��з��ӵ���ĿΪ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Һ�м��ữ��BaCl2��Һ����Һ���ְ�ɫ������֤��ԭ��Һ����SO42- | |
| B�� | �ò�˿պȡ����ij��Һ������ɫ��Ӧ������ʻ�ɫ������Һһ����������Һ | |
| C�� | ����ͨ����ˮCuSO4����ĩ������֤��ԭ�����к���ˮ���� | |
| D�� | ������ͨ�����ʯ��ˮ����Һ����ǣ�֤��ԭ������CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ϸ�Ӧ | B�� | �ֽⷴӦ | C�� | �û���Ӧ | D�� | ���ֽⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ | B�� | �������ڼ��� | ||
| C�� | SiO2�������������� | D�� | NaHCO3�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com