
| A. | A元素与C元素形成的分子不可能是非极性分子 | |
| B. | A、C、D元素分别与氢元素形成的最简单氢化物中,D的氢化物沸点最高 | |
| C. | A、B、C、D四种元素的基态原子中,B的原子半径最大 | |
| D. | A、B、C、D 四种元素对应单质的晶体都是分子晶体 |
分析 短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A不能处于第一周期,A、C的原子序数的差为8,则A、C为同主族元素,令B原子最外层电子数为x,则A、C的最外层电子数为2x,A、B、C三种元素原子的最外层电子数之和为15,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,据此解答.
解答 解:短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A不能处于第一周期,A、C的原子序数的差为8,则A、C为同主族元素,令B原子最外层电子数为x,则A、C的最外层电子数为2x,A、B、C三种元素原子的最外层电子数之和为15,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素.
A.S、O元素可以形成SO3,为平面正三角形结构,为非极性分子,故A错误;
B.A、C、D元素分别与氢元素形成的最简单氢化物中分别为H2O、H2S、HCl,常温下水为液态,氯化氢、氯化氢为气体,故水的沸点最高,故B错误;
C.同周期随原子序数增大原子半径减小,电子层越多原子半径越大,故原子半径O<Cl<S<Al,故B正确;
D.氧气、硫、氯气可以形成分子晶体,但Al为金属晶体,故D错误,
故选:C.
点评 本题考查结构位置性质关系,难度中等,关键是利用奇偶性及A、C的原子序数相差8判断二者处于同一主族(短周期),注意短周期中原子序数相差8不一定为同主族,如H与F.


科目:高中化学 来源: 题型:选择题
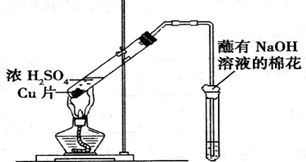
| 试管中试剂 | 试管中现象 | 解 释 | |
| A | 硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 白色沉淀为BaSO3 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2水溶液显酸性 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期第IIIA族 | B. | 第七周期第VA族 | ||
| C. | 第七周期第IIIB族 | D. | 第七周期第VB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
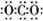 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| B. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属制成合金,可以保持甚至强化单一金属的长处,克服其不足 | |
| B. | 在自然环境中,锡青铜中的锡对铜起保护作用 | |
| C. | 锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生成Cu2(OH)3Cl覆盖物是化学反应过程,但不是电化学腐蚀过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
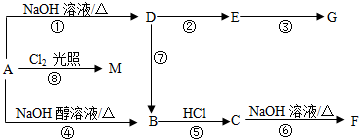
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
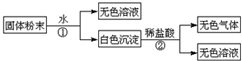
| 序号 | 化学式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
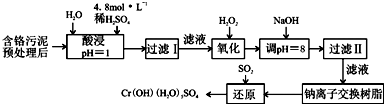
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com