
| 阳离子 | K+,Ba2+Fe2+Al3+ Fe3+ Mg2+ | ||||
| 阴离子 | OH-HCO
|
- 3 |
2- 3 |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、两种微粒,若核外电子排布完全相同,则其化学性质相同 |
| B、凡单原子形成的稳定离子,一定具有稀有气体元素原子的核外电子排布 |
| C、K+与Cl-通过静电引力结合形成离子化合物KCl |
| D、离子化合物中可以含有共价键,但共价化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(K+) | ||
n(
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
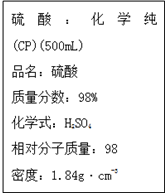 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、阴极(Cu片)2C1--2e-═Cl2↑ |
| B、正极(石墨棒):Fe3++e-═Fe2+ |
| C、阳极(Cu片):4OH--4e-═2H2O+O2↑ |
| D、负极(Fe钉):Fe-3e-═Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com