
| A. | ①②④ | B. | ①③⑤ | C. | ①③⑥ | D. | ③⑤⑥ |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g白磷晶体中含有的P-P键数是0.6NA | |
| B. | 标准状况下,11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA | |
| C. | 100g的98%的浓H2SO4中所含的氧原子数为4NA | |
| D. | 1molMnO2和足量浓盐酸充分反应后生成的气体在常温常压下的质量为71g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 这是一个电解池 | |
| B. | C作阴极,Cu作阳极 | |
| C. | 电解的过程实际上是电解水 | |
| D. | 石墨电极上的反应是4OH--4e-=O2↑+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min Z的平均速率υ(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
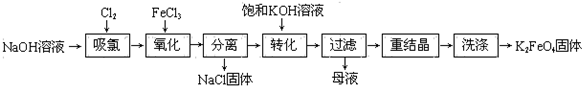
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发的过程中,用酒精灯一直加热到全部固体析出 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 | |
| C. | 对医用酒精进行蒸馏操作可得到更高纯度的酒精溶液 | |
| D. | 分液漏斗盛装的是液体,振荡后不必扭开旋塞把气体放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com