
(10分)为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1) 装置A中发生反应生成碱式氯化镁的化学方程式为_____________;装置B中碱石灰的作用是_______。
(2) 反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是_____________________。
(3) 装置C的试管中产生的现象是______________,反应的离子方程式为
(1)Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O 干燥氨气
MgOHCl+NH3↑+H2O 干燥氨气
(2)防止装置D中的AlCl3溶液倒吸入装置C
(3)产生白色沉淀 Al3++3NH3·H2O=Al(OH)3(沉淀)+3NH4+
解析试题分析:(1)装置A中的反应方程式为:Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O。碱石灰用来干燥生成的氨气。
MgOHCl+NH3↑+H2O。碱石灰用来干燥生成的氨气。
(2)氨气是极易溶于水的气体,在C装置处会发生倒吸,所以氮气的持续通入可以防止C装置发生倒吸。
(3)向AlCl3溶液中通入氨气只能看到产生白色沉淀,因为氨水是弱碱不能将Al(OH)3溶解。
考点:氨气的性质
点评:本题综合性较强,但是知识点很基础简单。


科目:高中化学 来源: 题型:
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为 。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42- 浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省启东中学高三上学期期中考试化学试卷 题型:实验题
(12分) 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲: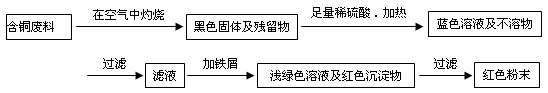
方案乙:
(1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________________,
若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为: ︰ 。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。
通过计算测知该晶体的化学式是 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:
Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南通市通州区高三4月查漏补缺专项检测化学试卷(带解析) 题型:计算题
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=—97.3kJ/mol
SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南通市通州区高三4月查漏补缺专项检测化学试卷(解析版) 题型:计算题
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l)
△H=—97.3kJ/mol
SO2Cl2(l)
△H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为 。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42- 浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:实验题
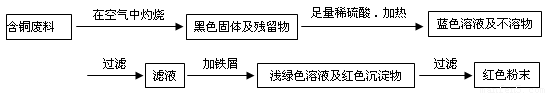
(12分) 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
方案乙:
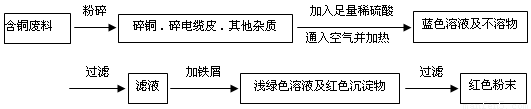
(1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________________,
若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为: ︰ 。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。
通过计算测知该晶体的化学式是 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 = 2 CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3 溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:
Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com