
| A. | Al2O3 | B. | MgO | C. | NaHCO3 | D. | Al(OH)3 |
分析 既能与盐酸反应又能与氢氧化钠溶液反应的物质有:两性化合物[如Al2O3、Al(OH)3等]、弱酸的铵盐[如(NH4)2CO3等]、弱酸的酸式盐(NaHCO3、NaHS等)、单质(如Al)、氨基酸、蛋白质等,既能跟盐酸反应,又能跟氢氧化钠溶液反应的氢氧化物是两性氢氧化物,以此解答该题.
解答 解:A.Al2O3属于两性氧化物,既能跟盐酸反应,又能跟氢氧化钠溶液反应,但不是氢氧化物,故A不符合;
B.MgO水碱性氧化物,能与盐酸反应,不能与氢氧化钠反应,故B不符合;
C.NaHCO3属于弱酸酸式盐,能与盐酸反应生成氯化钠、水、二氧化碳,与氢氧化钠反应生成碳酸钠和水,但不是氢氧化物,故C不符合;
D.Al(OH)3属于两性氢氧化物,与盐酸反应生成氯化铝和水,与氢氧化钠反应生成偏铝酸钠和水,故D符合,
故选D.
点评 本题考查了元素化合物的性质,难度不大,注意归纳总结常见能与酸、碱反应的物质,注意题目要求为氢氧化物,学生容易忽略,是易错点.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
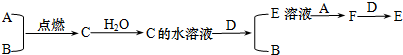
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热 | B. | 加入催化剂 | C. | 减小压强 | D. | 增加C的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中,加入KCl固体,溶液颜色加深 | |
| B. | 对2NO2?N2O4的平衡体系增大压强,平衡后气体颜色变浅 | |
| C. | 对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,容器内气体颜色变深 | |
| D. | 向滴有石蕊的醋酸溶液中通入HCl气体,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com