
 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.分析 (1)根据盖斯定律书写目标热化学方程式;
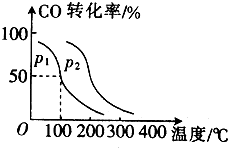
(2)①反应是气体体积减小的反应,温度一定时,增大压强平衡正向进行,CO的转化率增大;
②100°C时一氧化碳的转化率为50%,结合平衡三段式计算平衡浓度,代入平衡常数平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;上述条件下达平衡后,再向容器中充入a mol CO和2a mol H2,相当于加压,平衡向气体体积缩小的方向移动;平衡常数只受温度影响;
(3)盐对应的酸越弱,对应盐水解程度越大,碱性越强,pH值越大;向0.1mol/L的HCOOH溶液中加水,越稀越电离,平衡正向移动,加入少量HCOONa晶体时,HCOO-离子浓度变大,电离解平衡逆向移动.
解答 解:(1)①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90kJ/mol
依据盖斯定律,①+②-2×③得到:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol,
故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol;
(2)①由图象可知,相同温度下P2压强下一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2;
故答案为:<;
②向VL恒容密闭容器中充入a mol CO与2a mol H2,100°C时一氧化碳的转化率为50%,故CO浓度变化量为
$\frac{0.5amol}{VL}$=$\frac{a}{2V}$mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L):$\frac{a}{V}$ $\frac{2a}{V}$ 0
变化量(mol/L):$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
平衡量(mol/L):$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{a}{2V}}{\frac{a}{2V}×(\frac{a}{V})^{2}}$=$\frac{{V}^{2}}{{a}^{2}}$,
上述条件下达平衡后,再向容器中充入a mol CO和2a mol H2,相当于加压,平衡向气体体积缩小的方向移动,即正向移动,CO的体积分数会减小;平衡常数只受温度影响,温度不变,平衡常数不变,
故答案为:$\frac{{V}^{2}}{{a}^{2}}$;减小;不变;
(3)盐对应的酸越弱,对应盐水解程度越大,碱性越强,pH值越大,已知25℃时0.1mol/L的HCOOH溶液和0.1mol/L的CH3COOH溶液的pH分别为2.3和2.9,所以HCOOH的酸性强于CH3COOH,所以pH由大到小为:②>①>③;向0.1mol/L HCOOH溶液中加水或加入少量HCOONa晶体时,都会引起的变化是:
a.加水稀释后,平衡正向移动,氢离子物质的量增大,但外界条件是主要的,稀释后氢离子浓度是减小的,酸性减弱,PH增大;加入少量HCOONa晶体时,HCOO-离子浓度变大,电离平衡逆向移动,氢离子浓度减小,酸性减弱,PH值增大,故a正确;
b.加水,越稀越电离,平衡正向移动,电离程度增大;加入少量HCOONa晶体时,HCOO-离子浓度变大,电离解平衡逆向移动,电离程度减小,故b错误;
c.加水后离子浓度变小,导电能力减弱;加入加入少量HCOONa晶体后,离子浓度变大,溶液的导电能力增强,故c错误;
d.加水使溶液中氢离子浓度减小,温度不变,水的离子积常数KW不变,c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$,则c(OH-)增大;加入少量HCOONa晶体后,电离平衡逆向移动,氢离子浓度减小,溶液中c(OH-)增大,故d错误;
故答案为:②>①>③;a.
点评 本题考查热化学方程式、化学平衡图象及影响因素、平衡常数有关计算等,题目难度中等,注意掌握化学平衡三段式解题法,弱电解质电离,侧重考查外界条件改变对电离平衡的影响,注意掌握基础知识的掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
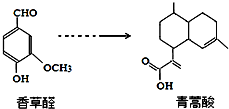 下列叙述正确的是( )
下列叙述正确的是( )| A. | 青蒿酸分子能在NaOH溶液中发生水解反应 | |
| B. | 在一定条件下,香草醛分子最多有16个原子共面 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 用FeCl3溶液或NaHCO3溶液都可以鉴别香草醛和青蒿酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
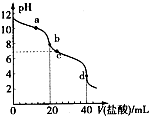 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )| A. | a点:c(CI-)>c(M+)>(OH-)>c(H+) | |
| B. | b点:MOH和HCl恰好完全反应 | |
| C. | c点:c(H+)=c(OH-)+c(MOH) | |
| D. | a点到d点:水电离的c(H+)•c(OH-)先变大,后变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z |
| R |
| A. | R的氧化物对应的水化物一定是强酸 | |
| B. | X、Y、Z三种元素既能形成共价化合物又能形成离子化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10个电子的微粒有2种 | |
| D. | Z、W形成的化合物中只能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OCH2CH2CH3 | B. | CH3CH(OH)CH2CH3 | C. | (CH3)2CHCH2OH | D. | CH3CH2CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的含氧酸一定是强酸 | |
| B. | 原子半径:X>Z | |
| C. | 气态氢化物热稳定性:W>X | |
| D. | W、X与H形成化合物的水溶液可能呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com