

 ��F�Ľṹ��ʽΪ
��F�Ľṹ��ʽΪ ��
��
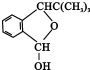 ��
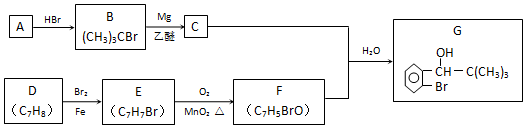
�� ���� ��B�Ľṹ��֪A��HBr�����ӳɷ�Ӧ����B����AΪCH2=C��CH3��2��B������Ϣ�з�Ӧ����CΪ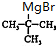 �����G�Ľṹ��F����ʽ�뷴Ӧ��Ϣ����֪FΪ
�����G�Ľṹ��F����ʽ�뷴Ӧ��Ϣ����֪FΪ ����ת����ϵ��֪DΪ
����ת����ϵ��֪DΪ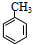 ��EΪ
��EΪ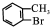 ���Դ˽��1������4����
���Դ˽��1������4����
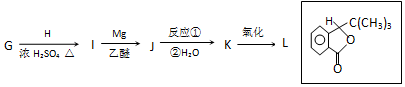
��5��K��������L����L�Ľṹ��ʽ���ƿ�֪KΪ ����ת����ϵ�������Ŀ��Ϣ��֪��JΪ
����ת����ϵ�������Ŀ��Ϣ��֪��JΪ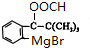 ��IΪ
��IΪ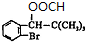 ��HΪHCOOH���Դ������
��HΪHCOOH���Դ������
��� �⣺��1��AΪCH2=C��CH3��2������Ϊ��2-��-1-��ϩ��G�еĹ����������ǣ��ǻ�����ԭ�ӣ�
�ʴ�Ϊ��2-��-1-��ϩ���ǻ�����ԭ�ӣ�
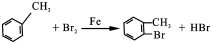
��2��D-E�Ļ�ѧ��Ӧ����ʽΪ ��F�Ľṹ��ʽΪ
��F�Ľṹ��ʽΪ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��3��B�й�����Ϊ��ԭ�ӣ�������������ˮ��Һ�����������·���ˮ�ⷴӦ��Ȼ���������ữ���ټ�����������Һ�����ɵ���ɫ������
�ʴ�Ϊ��NaOH��Һ��ϡHNO3��AgNO3��Һ��
��4����������������G��ͬ���칹�壺����FeCl3��Ӧ������ɫ��Ӧ��˵�����з��ǻ����ڱ�����һ�ȴ���ֻ��һ�֣�������ֻ��1��Hԭ�ӣ��ۺ˴Ź�������ֻ���������շ壬���ܵĽṹ��ʽΪ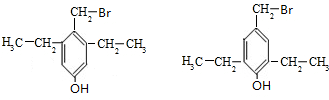 ����2�֣�
����2�֣�
�ʴ�Ϊ��2��
��5��K��������L����L�Ľṹ��ʽ���ƿ�֪KΪ ����ת����ϵ�������Ŀ��Ϣ��֪��JΪ
����ת����ϵ�������Ŀ��Ϣ��֪��JΪ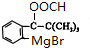 ��IΪ
��IΪ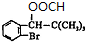 ��HΪHCOOH��
��HΪHCOOH��
�ʴ�Ϊ��HCOOH�� ��
��
���� ���⿼���л���ĺϳɣ�Ϊ��Ƶ���㣬���պϳ������й����ŵı仯���л���ӦΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע����ϳɷ���Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
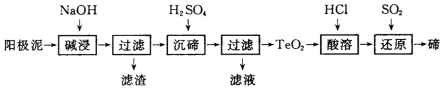
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
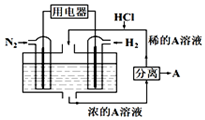 ����������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ�����������ȼ�ϵ�أ�װ����ͼ��ʾ�������й�˵����ȷ���ǣ�������
����������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ�����������ȼ�ϵ�أ�װ����ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | ͨ��N2��һ��Ϊ���� | |
| B�� | ͨ��H2�ĵ缫��ӦΪ��H2+2e-=2H+ | |
| C�� | ����A��NH4Cl | |
| D�� | ��Ӧ���������������ҺpH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/min | 0 | 2 | 4 | 7 | 9 |
| n��B��/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A�� | ��Ӧǰ2 min��ƽ������v��C��=0.004 mol/��L•min�� | |
| B�� | �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv ���棩��v ������ | |
| C�� | �����������䣬��ʼʱ�������г���0.64mol A��0.64mol B��ƽ��ʱn��C����0.48mol | |
| D�� | �����������䣬��ƽ����ϵ���ٳ���0.32mol A���ٴ�ƽ��ʱ��B��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬŨ�ȡ�ͬ�����ǿ����ǿ����Һ��Ϻ���Һ��pH=7 | |
| B�� | pH=2��������pH=12�İ�ˮ�������Ϻ�������ҺpH=7 | |
| C�� | pHΪa��CH3COOH��Һ��pHΪb��NaOH��Һ��Ϻ���Һ�����ԣ���aһ������b | |
| D�� | ��10mLpH=a��������100 mLpH=b��Ba��OH��2��Һ��Ϻ�ǡ���кͣ���a+b=13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ���г�����ɫ���� | |
| B�� | ����������Cu��OH��2+2OH-?Cu��OH��42-�����ƶ��Ľ�� | |
| C�� | ��������֤�������Ǿ��л�ԭ�� | |
| D�� | �ԱȢںܿ͢�֪Cu��OH��2������ǿ��Cu��OH��42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ͼ��NaCl����ֻ��������״̬�����Ӽ�����ȫ�ƻ��������γ������ƶ������� | |
| B�� | 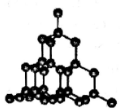 ��ͼ�����ʯ�д��ڵĻ�ѧ��ֻ�й��ۼ������ܵ��� | |
| C�� | 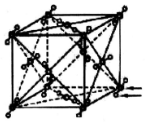 ��ͼ���ɱ��еĻ�ѧ��ֻ�����պ��ٵ������Ϳ����ƻ������Ըɱ��������� | |
| D�� | 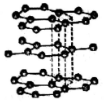 ��ͼ��ʯī��̼ԭ�ӵ��������Ӷ������˹��ۼ����γɣ����۵�ܸߡ�Ӳ�Ⱥܴ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com