
| A. | 2Na2O2+2CO2═2Na2CO3+O2,所以2Na2O2+2SO2═2Na2SO3+O2 | |
| B. | 电解熔融NaCl可以得到单质钠,所以电解熔融AlCl3也能得到单质铝 | |
| C. | CH4的空间构型是正四面体,所以CH3Cl的空间构型也是正四面体 | |
| D. | H2S的沸点比H2O低.所以PH3的沸点也比NH3低 |
分析 A、过氧化钠具有强氧化性,而二氧化硫具有还原性;
B、氯化铝是共价化合物;
C、CH3Cl中碳氢键与碳氯键的键长不同,所以空间构型是四面体;
D、水分子间和氨分子间都存在氢键.
解答 解:A、过氧化钠具有强氧化性,而二氧化硫具有还原性,过氧化钠与二氧化硫反应生成硫酸钠,故A错误;
B、氯化铝是共价化合物,熔融的氯化铝无法电解得到单质铝,故B错误;
C、CH3Cl中碳氢键与碳氯键的键长不同,所以空间构型是四面体,而不是正四面体,故C错误;
D、水分子间和氨分子间都存在氢键,氢键的存在分子间的作用力增强,熔沸点升高,所以H2S的沸点比H2O低,PH3的沸点也比NH3低,故D正确;
故选D.
点评 本题考查类推这一思维方法在化学学科中的应用,属于方法与知识相结合的内容,是高考的热点之一.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
| A组物质 | 熔点/K | B组物质 | 熔点/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原混合气体的体积为1.2V | B. | 原混合气体的体积为1.1V | ||
| C. | 反应达平衡时气体B消耗掉0.05V | D. | 反应达到平衡时气体A消耗掉0.05V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
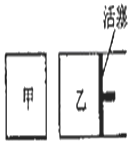 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )| A. | 无法确定 | B. | a<b | C. | a=b | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应区分氢氧化铁胶体与氯化铜溶液 | |
| B. | 用澄清石灰水鉴别NaHCO3和Na2CO3 | |
| C. | 用分液法分离植物油和水的混合物 | |
| D. | 用淀粉溶液检验食盐溶液中是否存在I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com