
分析 由:CaCl2 +Na2CO3 ═CaCO3↓+2NaCl
111 106 100
100g×11.1% 100g×21.2%
所以碳酸钠过量,则生成碳酸钙为10g,物质的量为0.1mol,而1mol碳酸钙需要2mol的盐酸,所以需盐酸为0.2mol,根据碳守恒求二氧化碳的物质的量,由此分析解答.
解答 解:由:CaCl2 +Na2CO3 ═CaCO3↓+2NaCl
111 106 100
100g×11.1% 100g×21.2%
所以碳酸钠过量,则生成碳酸钙为10g,物质的量为0.1mol,而1mol碳酸钙需要2mol的盐酸,所以需盐酸为0.2mol,根据碳守恒求二氧化碳的物质的量为0.1mol,故答案为:0.2mol;0.1mol.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.


科目:高中化学 来源: 题型:解答题
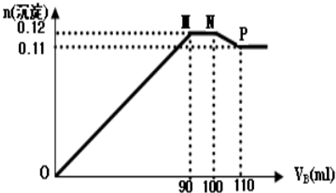
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Na2SiO3溶液中 | |
| B. | 向AlCl3溶液中滴加稀氨水至过量 | |
| C. | 少量的CO2通入BaCl2溶液中 | |
| D. | 向FeCl3溶液中滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
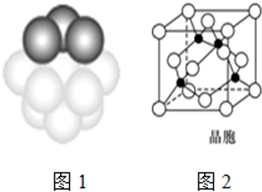
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
序号 | 时间/min 物质的量/mol 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com