
【题目】已知有以下物质相互转化,试回答:

(1)写出B的化学式_________________。
(2)写出由E转变成F的化学方程式_____________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式__________________________________; 向G溶液加入A的离子方程式_____________________________________。
【答案】 FeCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe3++3SCN-![]() Fe(SCN)3 2Fe3++Fe=3Fe2+
Fe(SCN)3 2Fe3++Fe=3Fe2+
【解析】白色沉淀E遇空气变成红褐色沉淀F,所以E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应得到G溶液,则G为FeCl3.D溶液中加AgNO3溶液、稀HNO3,有白色沉淀H生成,所以H是AgCl,得到的溶液进行焰色反应呈紫色(透过蓝色的钴玻),溶液中含有K+离子,所以D是KCl;B溶液与C溶液反应生成Fe(OH)2和KCl,G溶液(FeCl3溶液)与A 反应到B,则B为FeCl2,C为KOH,A为Fe,A反应得到B与气体,应是Fe与盐酸反应,气体为氢气,
(1)由以上分析知,B是FeCl2;
(2)由E转变成F的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)用KSCN鉴别FeCl3溶液的离子方程式为:Fe3+3SCN=Fe(SCN)3;向FeCl3溶液加入Fe的离子反应方程式为:2Fe3++Fe=3Fe2+。


科目:高中化学 来源: 题型:
【题目】已知还原性I﹣>Fe2+>Br﹣ , 下列离子方程式正确的是( )
A.将少量Cl2通入FeBr2溶液中:Cl2+2Br﹣═Br2+2Cl﹣
B.将足量Cl2通入FeBr2溶液中:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣
C.将少量Cl2通入FeI2溶液中:2Fe2++2I﹣+3Cl2═2Fe3++2I2+6Cl﹣
D.将672mLCl2(标况)通入250mL 0.1molL﹣1的FeI2溶液中:2Fe2++10I﹣+6Cl2═12Cl﹣+5I2+2Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
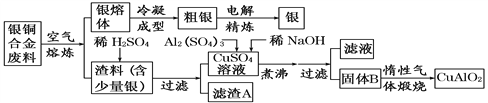
[注:Al(OH)3和Cu(OH)2 开始分解的温度分别为450℃和80℃]
(1)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为_________________。
(2)固体混合物B的组成为__________、__________。
(3)完成煅烧过程中一个反应的化学方程式:__________________________________↑。
(4)若银铜合金中铜的质量分数为64.0%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是___________、__________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复到原浓度,应加入的物质是
A. CuO B. H2O C. CuSO4 D. Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置进行木炭粉和浓硫酸的反应及其全部产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高锰酸钾溶液通入足量的二氧化硫气体,溶液的紫红色会完全褪去。
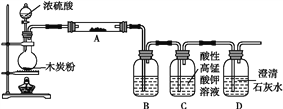
(1)组装好上述装置后,首先要进行的操作是________________。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:_________________。
(3)装置A中试剂的化学式为______,装置B的作用是____________________________。
(4)实验时,可以说明生成二氧化碳的实验现象是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离(括号内的物质为杂质)的方法错误的是( )
A.硝基苯(苯)--蒸馏
B.乙烯(SO2)--氢氧化钠溶液
C.己烷(己烯)--溴水,分液
D.乙酸乙酯(乙醇)--碳酸钠溶液,分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com