
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g) B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.前50 s内B的平均反应速率v(B)=0.0032 mol·L-1·s-1
B.相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol·L-1,则反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:简答题
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为 ;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
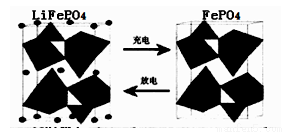
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:选择题
下列关于实验的描述错误的是
A.将硫酸铜溶液加热蒸发、浓缩、冷却结晶,可以制备硫酸铜晶体
B.测定等浓度NaClO溶液和Na2SO4溶液的pH,比较Cl、S元素的非金属性强弱
C.萃取法除去NaBr溶液中的少量NaI,需要用烧杯、玻璃棒、胶头滴管、分液漏斗
D.检验Na2SO3固体是否被部分氧化:取少量固体溶于水,滴加过量稀盐酸,观察是否产生气泡,再滴加BaCl2溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:简答题
【化学——化学与技术】(15分)将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时转移的电子为 __ mol。
NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时转移的电子为 __ mol。
(3)海水提取镁的一段工艺流程如下图:
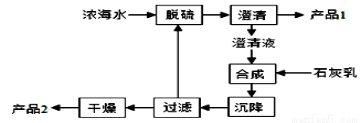
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42 - |
浓度(gL-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1 L浓海水最多可得到产品2的质量为 ______g。
(4)采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:简答题
【化学——选修5:有机化学基础】(15分)6-羰基庚酸是一种重要的化工中间体,其合成路线如下:

已知:
(1)反应①的条件是 ,C→D的反应类型是 ,C中官能团的名称是 。
(2)下列说法中正确的是( )
a.C能被催化氧化成酮
b.D不能使酸性高锰酸钾溶液褪色
c.Ni催化下1mol E最多可与2molH2加成
d.G既能发生取代反应,又能发生加成反应
(3)E与新制Cu(OH)2反应的化学方程式为 。
(4)G的同分异构体有多种,满足以下条件的同分异构体有 种。
A.分子中含有环己烷的结构
B.能与NaHCO3溶液反应,放出气体
C.1mol该物质能与2molNa完全反应
(5)已知“Diels-Alder反应”为: 。物质D与呋喃(
。物质D与呋喃(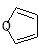 )也可以发生“Diels-Alder反应”,该化学反应方程为: 。
)也可以发生“Diels-Alder反应”,该化学反应方程为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol/L氨水中滴加0.l mol/L盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-a mol/L
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A.①④ B.②④ C.①③ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:推断题
(B)(13分)根据以下转化关系(所有无机产物均已略去)。回答下列各问:

(1)在编号(I)~(VI)的六个反应中,属于取代反应的有(填反应编号) 。
(2)写出指定物质的结构简式:F ;I 。
(3)写出下列反应的化学方程式:
B转化为D的化学方程式: 。
G转化为H的化学方程式: 。
(4) 的同分异构体甚多,其中属于酚的同分异构体共有 种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: 。
的同分异构体甚多,其中属于酚的同分异构体共有 种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:简答题
(15分)催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s) +8SO2(g) △H=―3412 kJ·mol-1
2SO2(g)+O2(g)  2SO3(g) △H=―196.6 kJ·mol-1
2SO3(g) △H=―196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=―130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为 kJ。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为 。


(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com