
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中加入少量铁粉即能观察到红色固体析出 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 | |
| C. | 该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 | |
| D. | 向该混合溶液中加入适量氯水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液 |
分析 A.等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液中阳离子氧化性顺序是Fe3+>Cu2+>Fe2+;铁粉和阳离子发生氧化还原反应顺序进行;
B.依据图表分析,铁离子开始沉淀的pH=3分析;
C.铁离子、亚铁离子、铜离子水溶液中水解;
D.混合溶液中加入氯水氧化亚铁离子为铁离子,调节溶液PH3-4铁离子沉淀完全,过滤得到溶液是硫酸铜溶液和盐酸、硫酸溶液.
解答 解:A.溶液中阳离子氧化性顺序是Fe3+>Cu2+>Fe2+;加入铁粉先和铁离子发生氧化还原反应,所以开始无红色固体析出,故A错误;
B.依据阳离子沉淀的PH可知加入氢氧化钠溶液先沉淀的是氢氧化铁,最先看到的是红褐色沉淀,故B错误;
C.等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液中设物质的量为1mol,n(SO42-)=5mol,n(Cu2+)+n(Fe2+)+n(Fe3+)=4mol,但Cu2+、Fe2+、Fe3+在水溶液中发生水解,所以该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4,故C正确;
D.向该混合溶液中加入适量氯水,加入氯水氧化亚铁离子为铁离子,发生反应6FeSO4+3Cl2=2Fe2(SO4)3+2FeCl3,并调节溶液的pH为3-4,然后过滤,得到溶液是硫酸铜溶液和氯化铜溶液,不能得到纯净的CuSO4溶液,故D错误;
故选C.
点评 本题考查氧化还原反应顺序判断,离子沉淀条件的分析判断,盐类水解的应用,除杂实验方法的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 序号 | 时间 浓度 温 度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | c1 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
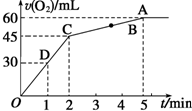 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
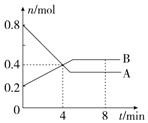 Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| B. | 漂白粉中的CaCl2与空气中的CO2反应可生成CaCO3,漂白粉在空气中久置变质 | |
| C. | NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验 | |
| D. | 打磨磁石制指南针不涉及化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液中不存在分子 | |
| B. | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | |
| C. | 某溶液的PH=7,该溶液一定呈中性 | |
| D. | 不溶性盐都是弱电解质,可溶性酸和强碱都是强电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com