
下列在指定溶液中的各组离子,能够大量共存的是
A.使无色酚酞变红的溶液中:S2—、K+、CO32—、C1—
B.1mol·L—1的氯化铁溶液中:Na+、C1—、SCN—、Cu2+
C.PH=0的溶液中:S2—、I—、Mg2+、Ba2+
D.水电离的C(H+)=10—13mol·L—1的溶液中:Fe2+、SO42—、K+、NO3—
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
下列条件下,离子能大量共存或者离子方程式正确的是( )
A、pH=1的溶液中:Fe2+、ClO-、Na+、SO42-
B、在含较多Al3+的溶液中:K+、Cl-、HCO3-
C、一小块钠投入到CuSO4溶液中:2Na+Cu2+= Cu+2Na+
D、铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2++ 2NO↑+ 4H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:推断题
【有机物化学基础】
某有机物X的相对分子质量小于100,取1 mol有机物X在O2中完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2 112 L。
(1)该有机物X的分子式为________(填序号)。
A C4H8 B C2H4O C C4H8O2 D C10H20O20
(2)甲物质是X的同分异构体,分子中含有羰基和羟基,甲物质能发生如图所示的转化:
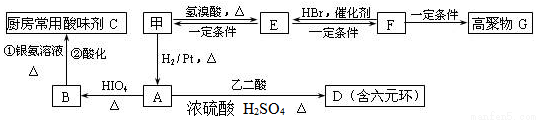
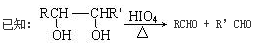
①B的名称是________。与A官能团相同的同分异构体共有______种(包括A但不含立体异构,已知同一个碳上有两个羟基的有机物不稳定)
②A→D的反应类型为________,E→F的反应条件是________。
③写出F→G的化学方程式__________________________________。
(3)物质乙也是X的同分异构体,1 mol乙与足量的Na反应可生成1 mol H2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上。乙的核磁共振氢谱图中有3个峰,面积之比为2∶1∶1。物质乙的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:简答题
含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为________。
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该
反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆 )
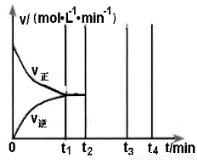
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。
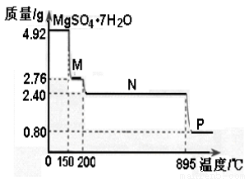
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列化学用语表示正确的是
A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6kJ/mol
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO-+H2O RCOOH+OH-
RCOOH+OH-
C.实验室制氯气的离子方程式:MnO2+4H++4Cl-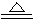 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:简答题
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示
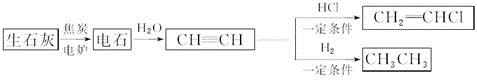
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
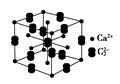
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:推断题
【有机物化学基础】
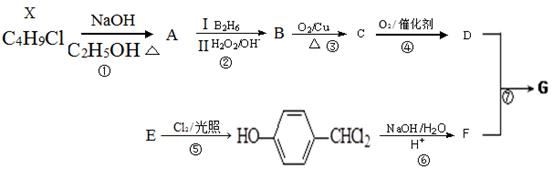
有机物G是制备液晶材料的中间体之一,其结构简式为:
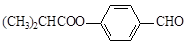
G的一种合成路线如下:其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:X的核磁共振氢谱只有1种峰;RCH=CH2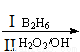 RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)A的结构简式是 ;C中官能团的名称是 。
(2)B的名称是 。第①~⑦步中属于取代反应的有 (填步骤编号)
(3)写出反应⑤的化学方程式 。
(4)第⑦步反应的化学方程式是 。
(5)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的所有同分异构体的结构简式 。
a.苯环上的一氯代物有2种; b.水解生成二元羧酸和醇。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
 (1)已知:2NO2(g)
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
其他条件不变时,下列措施不能使NO2转化率提高的是

 A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2 O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。
 (4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合1 题型:简答题
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是 周期 族。
(2)A与C形成的18电子分子的结构式为 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如右图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
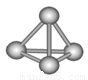
A.B4比P4(白磷)既含有极性键又含有非极性键
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
T/K | 303 | 313 | 323 |
BA3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com