
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与稀硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
【提出假设】
假设1:铁矿石中只含+3价铁; 假设2:铁矿石中只含+2价铁;
假设3: 。
【查阅资料】2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
【定性研究】 【实验一】
取铁矿石样品粉碎,盛于烧杯中,加入适量的X溶液,微热,充分溶解后将滤液分成四份:
①向第一份溶液中滴加少量KSCN溶液;
②向第二份溶液中滴加适量高锰酸钾溶液;
③向第三份溶液中滴加少量KSCN溶液,再滴加适量双氧水溶液;
④向第四份溶液中滴加适量氢氧化钠溶液.
(1)上述X溶液是 (填“稀硝酸”、“稀硫酸”或“浓盐酸”);上述方案中,一定能证明铁矿石中含+2价铁的方案是 (填序号).
【定量研究】 【实验二】铁矿石中含氧量的测定:
①按图组装仪器,检查装置的气密性;②将5.0g铁矿石放入硬质玻璃管中,其他装置中的药品如图所示(夹持装置已略去);③A中开始反应,不断地缓缓向后续装置中通入氢气,待D装置出口处氢气验纯后,点燃C处酒精灯;④充分反应后,撤掉酒精灯,再持续通入氢气直至完全冷却.
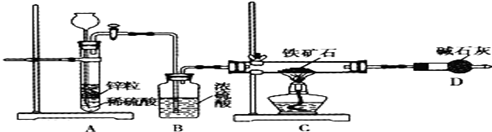
(2)按上述方案进行多次实验,假设各项操作都正确,但最终测得结果都偏高,请你提出改进方案的建议: .如果拆去B装置,测得结果可能会 (填“偏高”、“偏低”或“无影响”).
(3)改进方案后,测得反应后D装置增重1.35g,则铁矿石中氧的百分含量为 。若将H2换成CO,则还需补充 装置.有同学认为,不测定D装置的净增质量,通过测定物理量 ,也能达到实验目的.
【实验三】铁矿石中含铁量的测定:
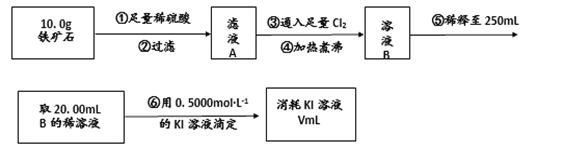
(4)步骤④中煮沸的作用是 ;
(5)步骤⑤中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有 .
(6)下列有关步骤⑥的说法中正确的是 (填序号).
a.因为碘水为黄色,所以滴定过程中不需要加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不能用待装液润洗
e.滴定过程中,眼睛应注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(7)若滴定过程中消耗0.5000mol•L-1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。综合实验(二)的结果,可以推算出该铁矿石中铁的氧化物的化学式为 。
【知识点】常见实验操作步骤、实验方案的设计与评价
【答案解析】 假设3:铁矿石中同时含有二价铁和三价铁 (1分)
(1)稀硫酸 (1分) ② (填序号) (1分)
(2)在D后加一干燥装置;(2分) 偏高;(1分)
(3)24% ;(1分) 尾气处理,(1分) 硬质玻璃管在反应前后的质量变化;(1分)
(4)赶走多余的氯气;(1分) (5)250ml容量瓶;(1分)
(6)df ;(1分) (7)70% ;(1分) Fe5O6 (2分)
解析:铁矿石中主要研究含铁的氧化物,假设1:铁矿石中只含+3价铁; 假设2:铁矿石中只含+2价铁;所以假设3:铁矿石中同时含有二价铁和三价铁。(1)X是用来溶解铁矿石的,浓盐酸会和高锰酸钾反应,稀硝酸也具有氧化性,故只能选择稀硫酸;①③④中都有三价铁的干扰,只有②褪色才能证明一定含亚铁离子;(2)实验方案中氢气还原氧化物的产物水被干燥管D吸收,根据干燥管增重计算,空气中的水蒸气也会进入D,导致结果偏高,故应在D后加一干燥装置;如果拆去B装置,会有水蒸气从制氢气装置中出来,造成测得结果偏高;(3)测得反应后D装置增重1.35g,水的质量,其中的氧来自铁矿石,m(O)=1.35g×16/18=1.2g,铁矿石共5.0g,则铁矿石中氧的百分含量=1.2÷5.0×100%=24%;
若将H2换成CO,CO有污染,还需补充尾气处理装置;不测定D装置的净增质量,通过测定物理量硬质玻璃管在反应前后的质量变化,也能达到实验目的;(4)如果溶液中混有氯气会和后面的KI反应影响测定结果,所以,步骤④中煮沸的作用是赶走多余的氯气;(5)步骤⑤是配制一定浓度的标准溶液,用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶;(6)a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,不能确定是否达到滴定终点,故b错误;c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;d.锥形瓶不需要用待测液润洗,故d正确;e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确;(7)根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI)=0.5000mol•L-1×0.020L=0.01mol,所以铁元素的百分含量=0.01mol×(250mL÷20mL)×56g/mol÷10.0g×100%=70% ;
铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为: =5:6,
=5:6,
该铁矿石中铁的氧化物的化学式: Fe5O6 ;
【思路点拨】本题考查了探究铁矿石中氧元素和铁元素的含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题综合性强,理论和实践的联系紧密,要求学生必须认真、细致的审题,联系所学过的知识和技能,全面细致的思考才能得出正确的结论。


科目:高中化学 来源: 题型:
下列措施有利于节能减排、改善环境质量的是
①研制开发新型燃料电池汽车,减少机动车尾气污染 ②开发推广太阳能、水能、风能等能源 ③使用填埋法处理未经分类的生活垃圾 ④推广使用燃煤脱硫技术,防治SO2污染
A.①②④ B.①② C.①②③④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子
的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ |
| 阴离子 | C1- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为 。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校研究性学习小组同学在实验时把SO2通入装有1mol/LBaCl2溶液的试管中,出现了白色浑浊物。
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/L BaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4。你认为所查阅的数据为: 。
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:

①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 全【品教学网, 用后离不了!注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.
②D中气泡均匀冒出并验纯全【品教学网, 用后离不了!后关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的 全【品教学网, 用后离不了!滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为 、 全【品教学网, 用后离不了!;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是: 。
(4)装置C中苯的作用是 。
(5)装置D的目的是 全【品教学网, 用后离不了!
(6)写出实验步骤⑤试管中发生反应的化学方程式 、 全【品教学网, 用后离不了!;
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、
无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:

(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,
再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O = 2I-+S4O
= 2I-+S4O ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。

①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO
2001年我国卫生部规定,饮用水的ClO 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:R—CH===CH2+HX—→
A、B、C、D、E有如下转化关系:
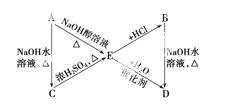
其中A、B分别是化学式为C3H7Cl的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1)A、B、C、D、E的结构简式:
A________、B________、C________、D________、E________。
(2)完成下列反应的化学方程式:
①A—→E_____________________________________________________;
②B—→D__________________________________________________;
③C—→E____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种有机合成中间体,其结构简式为:
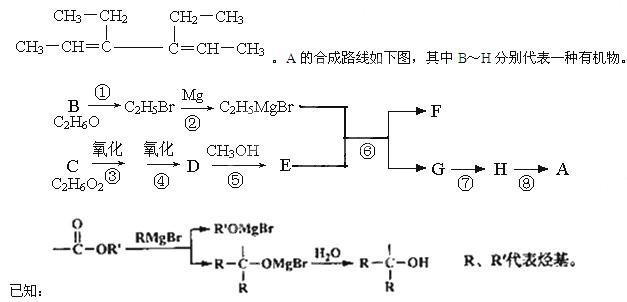
请回答下列问题:
(1)A中碳原子的杂化轨道类型有_____;A的名称(系统命名)是____;第⑧步反应类型是___。
(2)第①步反应的化学方程式是________。
(3)C物质与CH2=C(CH3)COOH按物质的量之比1:1反应,其产物经加聚得到可作隐形眼镜的镜片材料I。I的结构简式是_______________。
(4)第⑥步反应的化学方程式是________________。
(5)写出含有六元环,且一氯代物只有2种(不考虑立体异构)的A的同分异构体的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,目前射程最远的导弹是俄罗斯的“白杨一号”,正是复合材料的使用使导弹的射程更远。复合材料使导弹射程有了更大提高的原因是(双选)( )
A.复合材料的使用可以使导弹的动力更强劲
B.复合材料的使用可以使导弹质量变小
C.复合材料的使用可以使导弹承受超高强度的改变
D.复合材料的使用可以使导弹承受温度的剧烈变化
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。
(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 25.53 | 25.00 |
| 3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为 mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A. KBr B. KI C. K2S D. K2CrO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com