
| A. | Na2O2固体中阴、阳离子个数比为1:1 | |
| B. | 由酸性HCl>H2CO3,可推知非金属性Cl>C | |
| C. | pH均为5的CH3COOH溶液和NH4Cl溶液中水的电离程度相同 | |
| D. | 常温下,浓度均为0.1mol/L的HA酸溶液与NaOH溶液等体积混合后(pH约为8),溶液中离子浓度关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
分析 A.Na2O2晶体中阳离子为Na+、阴离子为O22-;
B.最高价含氧酸的酸性越强,对应元素的非金属性越强;
C.酸碱抑制水的电离,水解的盐促进水的电离;
D.常温下,浓度均为0.1mol/L的HA酸溶液与NaOH溶液等体积混合后(pH约为8),说明生成了强碱弱酸盐,则HA为弱酸,生成的NaA溶液中A-离子水解溶液显碱性;
解答 解:A.Na2O2晶体中阳离子为Na+、阴离子为O22-,所以Na2O2晶体中阴阳离子个数之比为1:2,故A错误;
B.最高价含氧酸的酸性越强,对应元素的非金属性越强,HCl不是最高价含氧酸,所以不能通过比较HCl与H2CO3的酸性来判断非金属性,故B错误;
C.pH均为5的CH3COOH溶液和NH4Cl溶液中,醋酸抑制水的电离.氯化铵溶液中铵根离子水解促进水的电离,水的电离程度氯化铵溶液中大,故C错误;
D.常温下,浓度均为0.1mol/L的HA酸溶液与NaOH溶液等体积混合后(pH约为8),说明生成了强碱弱酸盐,则HA为弱酸,生成的NaA溶液中A-离子水解溶液显碱性,溶液中离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了影响水的电离平衡因素分析、物质组成与结构、盐类水解原理和电解质溶液中离子浓度大小比较等知识点,题目难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
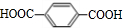 +2NaHCO3→
+2NaHCO3→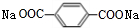 +2H2O+2CO2↑.
+2H2O+2CO2↑.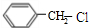 .
.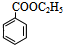 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$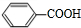 +CH3CH2OH.
+CH3CH2OH.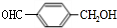 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n +n
+n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$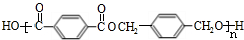 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
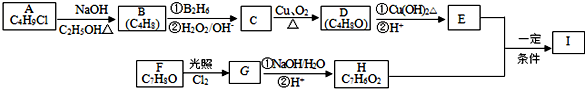
 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
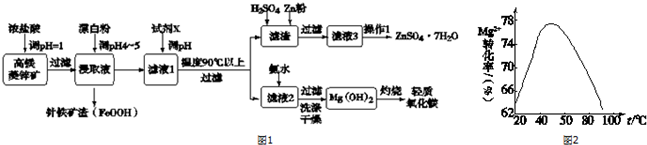
| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) | |
| D. | 反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的物质的量/mol | ||
| SO2 | O2 | SO3 | |||
| Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
| Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
| Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
| A. | 平衡时SO3的物质的量:a>1.2、b>1.2 | |
| B. | 容器Ⅱ、Ⅲ中平衡常数相同 | |
| C. | 容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 | |
| D. | 若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),则此时ν正<ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
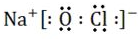 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com