
 目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.
目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.
| ||
| ||
| 5.4g |
| 108g/mol |
| ||
| n |
| V |
| 0.05mol |
| 0.5L |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、NH3?H2O |
| C、AgNO3 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | Al箔插入稀HNO3中 | 开始无现象 | Al箔表面被HNO3氧化钝化,形成致密的氧化膜 |
| D | 向浓度均为0.1mol?L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A、 | B、B、 | C、C、 | D、D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能发生加成反应 |
| B、淀粉和纤维素的分子式相同,互为同分异构体 |
| C、粮食酿酒的过程涉及到了水解反应、氧化还原反应等复杂变化 |
| D、向蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液,蛋白质均发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该物质的分子式为C25H20 |
| B、该物质所有氢原子不可能在同一平面上 |
| C、该物质属于烷烃 |
| D、该物质的一氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
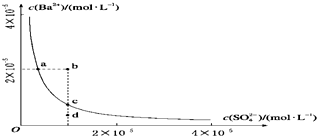
| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com