
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
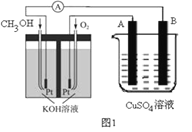
①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
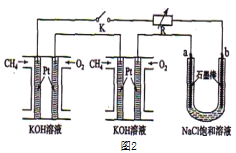
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____L(标准状况)。
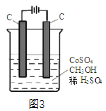
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。
【答案】 C2H5OH(l)+2O2(g)=2CO(g)+3H2O(l) ΔH1=-932.8kJ/mol CH3OH-6e-+ 8OH-=CO32-+6H2O B 1.12  4 Co2+-e-=Co3+(或6Co2+-6e-=6Co3+) 6Co3++CH3OH+H2O=6Co2++CO2↑+6H+
4 Co2+-e-=Co3+(或6Co2+-6e-=6Co3+) 6Co3++CH3OH+H2O=6Co2++CO2↑+6H+
【解析】(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol,②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol,③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:由盖斯定律方程式①-②+③×3得到C2H5OH(l)+2O2(g)=2CO(g)+3H2O(l) ΔH1=(-1366.8kJ·mol-1)-(-566kJ·mol-1)+(-44kJ·mol-1)×3=--932.8kJ/mol。(2)①CH3OH作还原剂,失电子,燃料电池负极的电极反应式:CH3OH-6e-+ 8OH-=CO32-+6H2O;②若利用该燃料电池提供电源,与图1右边烧杯相连,B与电池的负极相连,是阴极,A是阳极;在铁件表面镀铜,则铁件应是阴极,故选B。根据得失电子守恒:2Cu~O2,当铁件的质量增重6.4g时,燃料电池中消耗氧气6.4g/(2×64g·mol-1)== 0.05mol,标准状况下体积为22.4L·mol-1×0.05mol=1.12L;(3)根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若每个电池甲烷通入量为1 L(标准状况),生成4L Cl2;电解池通过的电量为![]() ×8×9.65×l04C·mol-1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算)。(5)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
×8×9.65×l04C·mol-1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算)。(5)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】对下列各实验装置的描述正确的是( )
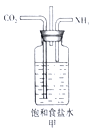

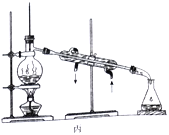

A. 甲装置可用来模拟工业制取NaHCO3,实验时为防止倒吸,应先通入CO2一段时间后再通NH3
B. 乙装置可用来萃取溴水中的溴,放出下层水后,另换洁净的烧怀放出有机层
C. 丙装置可用来分离四氯化碳和苯的混合物,其中直形冷凝管可用球形冷凝管代替
D. 丁装置可用来做喷泉实验,若在水中滴入少量酚酞,实验中可观察到红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a 20分钟后冷却至室温。
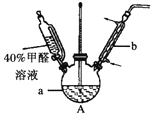
①仪器b的名称是_________;
②能说明甲醛具有还原性的实验现象是_________________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
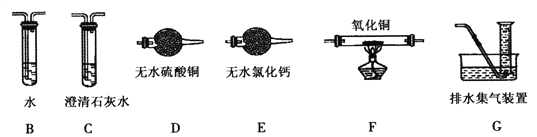
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_____________。有H2的实验现象是_________________________。
(3)已知:![]() 设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为研究其组成,进行如下实验(以下每步均充分反应):
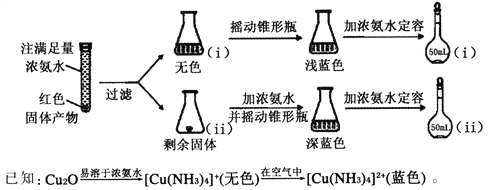
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,11.2 L的戊烷所含的分子数为0.5 NA
B. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA
C. 1 mol甲基的电子数目为7 NA
D. 28 g乙烯所含共用电子对数目为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个装置的说明符合实验要求的是
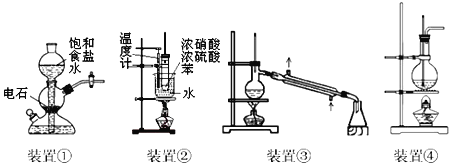
A. 装置①:实验室中若需制备较多量的乙炔可用此装置
B. 装置②:实验室中可用此装置来制备硝基苯.
C. 装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥形瓶中可获得碘
D. 装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料, 氯气极其相关产品在生产生活中应用广泛。结合氯气的相关知识解决下列问题;
(1)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是______________________;漂白粉的有效成分是(填化学式)_________。漂白粉在空气中长期存放会变质而失效的原理是(用化学方程式说明) _____________。
(2)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
(3)氯气是一种常用的消毒剂,新制氯水含多种微粒并表现出不同的性质(用化学式或离子符号填写):
使氯水呈黄绿色的是________;能使AgNO3溶液产生白色沉淀的是________;能使紫色石蕊试液显红色的是________;能使红纸褪色的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2的燃烧热为286 kJ/mol,Li的燃烧热为299 kJ/mol。LiH可做飞船燃料,合成LiH的热化学方程式是2Li(s)+H2(g)=2LiH(s)△H=-182kJ/mol,则LiH的燃烧热为( )
A. 702 kJ/mol B. 442 kJ/mol C. 585 kJ/mol D. 351 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com