
【题目】近些年,半导体材料在电子领域发展迅速,科学家一般在分界线出寻找半导体材料,如硅、锗、砷及GaAs等化合物。回答下列问题:
(1)基态As原子的外围电子排布式为________,原子核外有______个未成对电子。
(2)实验测得镓的氯化物的熔沸点显著低于其对应化合价的氯化物,其原因可能是_________。
(3)Ge、Se、As位于周期表第四周期,其第一电离能由大到小的顺序为______。
(4)AsH3分子的立体构型为 ______,其中As的杂化轨道类型为______。
(5)碳和硅属于同主族元素,碳能形成多种氢化物,但硅的氢化物很少且不稳定,试从原子结构角度分析可能的原因__________。
(6)GaAs晶胞结构如图所示,若A的坐标参数为(0,0,0),B为(0,1/2,1/2)、C为(1,0,0)、则D的坐标参数为_______。已知GaAs的晶胞边长为apm,其密度为_____ g·cm-3(列出计算式即可)。

【答案】 4s24p3 3 晶体类型不同,Ga的氟化物为离子晶体,Ga的氯化物为分子晶体 As、Se、Ge 三角锥形 sp3 碳原子的原子半径小,硅原子半径大,硅原子形成的共价键长长,不稳定 (3/4,3/4,3/4) ![]()
【解析】(1)As 为ⅤA 族33 号元素,电子排布式为 1s22s22p63s23p63d104s24p3。 故外围电子排布式为 4s24p3;核外未成对电子有3 个。
(2)镓的氯化物的熔沸点显著低于其对应化合价的氟化物说明它们不可能都是分子晶体,根据氟元素电负性最大可以预测镓的氟化物为离子晶体。
(3)根据元素周期律,Ge、Se、As 位于同一周期,同周期第一电离能从左到右,逐渐增大,但As原子最外层电子排布半充满,能量较低较稳定,故第一电离能Ga 小于As,As 大于Se。
(4)AsH3 中价层电子对个数=σ 键个数+孤电子对个数=3+(5-3×1)/2=4,所以As 原子杂化方式是sp3,由于有一对孤对电子,故分子空间构型为三角锥形。
(5)虽然碳和硅是同一主族的元素,但碳原子的原子半径小,硅原子半径大,硅原子形成的共价键键长长,不稳定。
(6) 根据晶胞中各个原子的相对位置可知,As 在顶点和面心,将立方体晶胞分割为8 个小正方体,Ga 在4 个交错的小正方体的体心,所以D 的坐标参数为(3/4,3/4,3/4);根据晶胞结构可知,在晶胞中含有的As 原子数是8×1/8+6×1/2=4,含有Ga 原子数为4×1=4,所以晶胞,所以晶胞的密度是![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】当光束通过下列物质:①尘埃的空气 ②氢氧化钠溶液 ③蒸馏水 ④淀粉溶液,能观察到有丁达尔现象的是
A. ①② B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列两种溶液中,室温下由水电离生成的H+浓度之比(①∶②)是 。
①pH=1的盐酸 ②0.01 mol·L-1的NaOH溶液
II.已知水在25℃和95℃时,其电离平衡曲线如图所示:
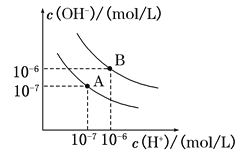
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”);95℃时水的离子积KW= 。
(2)25℃时,将pH=9的Ba(OH)2溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则Ba(OH)2溶液与H2SO4溶液的体积比为 。
(3)曲线A对应温度下,pH=2的盐酸溶液和pH=11的氢氧化钠溶液按体积比1:9混合,溶液的pH约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对立关系正确的是
选项 | 化学性质 | 实际应用 |
A | SO2具有还原性 | 漂白纸浆 |
B | HF具有弱酸性 | 在玻璃上刻字, |
C | 铝的金属活动性强于氢 | 用铝制容器贮运浓硝酸 |
D | FeCl3溶液能与Cu反应 | 蚀刻铜箔制造电路板 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到
蒸馏水中,所形成的分散系:①是溶液 ②是胶体 ③能产生丁达尔效应 ④分散质粒子能透过滤纸 ⑤分散质粒子不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4 s时测得各物质的浓度如表,则下列判断正确的是( )
测定时刻/s 浓度 | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t3 s时反应已经停止
B. t3~t4 s内正、逆反应速率不相等
C. 在容器中发生的反应为A(g)+B(g) C(g)
D. 在t2~t3 s内A的平均反应速率为![]() mol/(L·s)
mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1升甲气体和2升乙气体恰好完全化合生成2升丙气体(同温同压),若丙气体的分子式为YX2 , 则甲和乙的分子式依次为( )
A.X2 与Y2
B.XY 与X2
C.X2 与YX
D.YX 与Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是
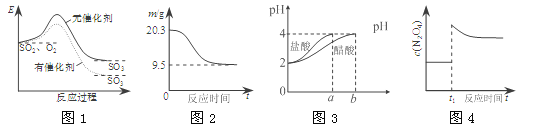
A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C.图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
D.图4表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com