
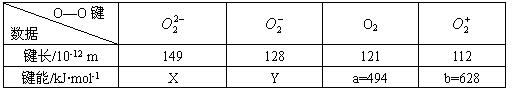
其中x,y的键能数据尚未测定,但根据规律推导,键能大小的顺序是b>a>y>x,该规律是( )
A.成键时,电子数越多键能越大
B.键长越短,键能越大
C.成键所用电子数越少,键能越大
D.成键时电子对越偏移,键能越大
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
 (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | A≡B | ||||
CO |
键能(KJ/mol) | 357.7 | 798.9 | 1071.9 | ||
| 键能差值(KJ/mol) | 441.2 | 273 | ||||
| N2 | 键能(KJ/mol) | 154.8 | 418.4 | 941.7 | ||
| 键能差值(KJ/mol) | 263.6 | 523.3 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:022
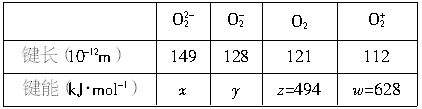
(2006·黄冈)已知共价键的键长是指分子中两个成键原子的核间距离.键能是在一定条件下拆开1 mol共价键所吸收的能量或生成1 mol共价键所放出的能量.下表所列数据是指在相同条件下,在不同物质中氧、氧之间的键长和键能的实测数据,其中a和b尚未测出,但根据一个较为可靠的原则可估计出a、b、c、d的大小顺序为________(由大到小),该原则可简述为________.

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com